«Неправильные» молекулы. Что такое D-аминокислоты и чем они важны с точки зрения нашего питания и здоровья
Откуда берется запах вин, сыров и квашеных продуктов? Всё дело в D-аминокислотах, которые являются зеркальным отражением L-аминокислот. А еще они препятствуют усвоению питательных веществ — и это совсем не минус, но, наоборот, большой плюс. Так какая же роль отведена им в нашей жизни и почему почти у каждой «обычной» аминокислоты есть свой D-аналог? Рассказывает Илья Чикунов.
— Меня зовут Яло. А тебя зовут Оля?
— Правильно! — воскликнула удивленная Оля. — Как ты узнала?
— Это очень просто. Ведь я твое отражение.
В. Губарев. «Королевство кривых зеркал»
Аминокислоты — главные строительные блоки белков, образующих клетки и ткани организма; они участвуют в метаболизме и выполняют множество разных функций. За исключением глицина, все протеиногенные аминокислоты существуют в виде двух структур, являющихся зеркальным отражением друг друга и называемых D- и L-энантиомерами. Долгое время считалось, что в ходе эволюции для синтеза белка и основного метаболизма использовались только L-аминокислоты. Однако D-аминокислоты тоже выполняют специфические функции в живых организмах — от формирования структуры клеточной стенки бактерий до модуляции передачи нервных импульсов в мозге млекопитающих. С появлением чувствительных методов анализа за последние несколько десятилетий было установлено, что многие продукты питания содержат заметные количества D-аминокислот: мы потребляем более 100 мг этих веществ каждый день. D-аминокислоты присутствуют в пище, обеспечивая не только характерный вкус и аромат, но неожиданные свойства, не проявляющиеся у соответствующих L-энантиомеров. Откуда берутся D-аминокислоты в продуктах питания, что означает их присутствие, как они влияют на организм человека и для чего применяются? Попробуем разобраться с этими вопросами.
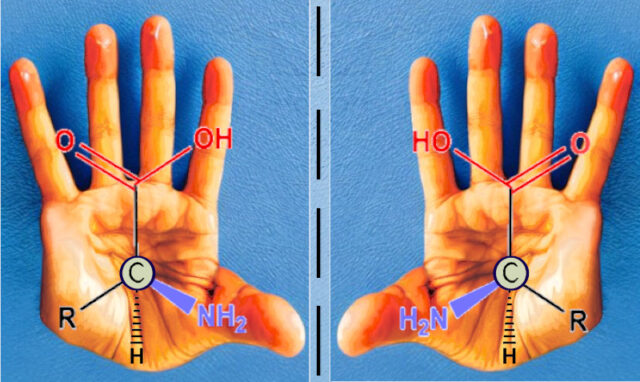
Необычные аминокислоты
Аминокислоты содержат α-углерод, С, соединенный с четырьмя функциональными группами: аминной NH2, карбоксильной COOH, водородом и боковой цепью R. α-Углерод является стереоцентром (или хиральным центром) молекулы, поскольку в зависимости от пространственного расположения этих четырех различных групп существуют два стереоизомера, которые выступают зеркальным отражением друг друга: Levo — левовращающий и Dextro — правовращающий.
Наиболее распространенными и известными являются L-аминокислоты — их изучают с начала XIX века. Следующие полтора века считалось, что лишь они служат основой белков живых организмов.
Однако это оказалось не совсем верно: молекулы, являющиеся зеркальными отражениями L-аминокислот, — D-аминокислоты — тоже оказались важными компонентами жизни.
D-аминокислоты как природные биомолекулы изучаются последние 50 лет. Более того, несмотря на одинаковые химические и физические свойства, выяснилось, что, кроме оптической активности, их биологическое действие разительно отличается от L-изомеров. Удивительно, но до сих пор в школьных учебниках по химии пишут, что «в природе встречаются только L-аминокислоты».
Самые простые и очевидные отличия аминокислот-антиподов — это вкус и запах. D-аминокислоты гораздо слаще своих зеркальных «родственников», что используется при разработке подсластителей. Особый запах D-аминокислот придает характерную пикантность выдержанным винам, сырам и квашеным продуктам.
Другое важное отличие — питательная ценность, также зеркальная для L- и D-изомеров. Если L-аминокислоты применяют как пищевые добавки для набора мышечной массы и в медицине — для внутривенного питания, то D-аминокислоты, наоборот, препятствуют усвоению питательных веществ, что дает возможность использовать их как средства для похудания.
Ряд D-аминокислот обладает свойствами, не присущими L-изомерам. Так, D-серин оказывает успокаивающее, антистрессовое действие и улучшает пространственную память. D-фенилаланин действует как обезболивающее, а D-аспарагиновая кислота и D-аланин при приеме внутрь омолаживают кожу.
Наконец, различается взаимодействие с ферментами организма. Эволюционно, наши ферменты приспособлены для расщепления белков и пептидов, состоящих из L-аминокислот. Поэтому их замена на зеркальные фрагменты препятствует разрушению таких молекул. Это позволяет целенаправленно конструировать стабильные пептиды, которые могут использоваться как лекарства. Среди ярких примеров «женская виагра» — бремеланотид (Vyleesi™), регенерант и репарант ЖКТ — даларгин, а также разрабатываемый противораковый препарат Cilengitide.
Присутствие D-аминокислот в организме животных было установлено в 1969 году: предполагалось, что они поступают с пищей или образуются из эндогенной микрофлоры в результате спонтанной рацемизации L-энантиомеров, то есть перехода при химических превращениях из L- в D-форму. Затем обнаружились специфические функции ряда D-аминокислот у млекопитающих. D-серин производится в мозге рацемазой и является основным коагонистом NMDA-рецепторов, как и D-аспарагиновая кислота. Эти аминокислоты влияют на передачу нервных импульсов и основные функции мозга — обучение и память. Кроме того, D-аспарагиновая кислота участвует в синтезе различных гормонов и мелатонина. Изменения концентраций D-аминокислот связаны с различными патологическими состояниями, такими как хронические заболевания почек и неврологические расстройства — шизофрения, болезнь Альцгеймера и др.
Интересно, что D-аминокислоты образуются в процессе обработки пищевых продуктов и вырабатываются под действием ферментов микроорганизмами в воде, почве и других средах. D-аминокислоты, в основном D-аланин и D-глутаминовая кислота, являются ключевыми компонентами пептидогликана в клеточной стенке бактерий. У большинства бактерий рацемазы превращают L-аланин и L-аспарагиновую кислоту в соответствующий D-энантиомер. D-аминокислоты делают клеточную стенку устойчивой к большинству протеаз — ферментов, расщепляющих белки и пептиды и ориентированных на L-структуру. Наличие на конце пептида альтернативных D-аминокислот, то есть D-аспарагиновой кислоты или D-серина, придает устойчивость к антибиотикам, например ванкомицину. Бактериальная флора человеческого организма и инфекции представляют собой постоянный эндогенный источник D-аминокислот.
У млекопитающих для усвоения D-аминокислот основной проблемой является не всасывание, поскольку транспортеры аминокислот обладают широкой специфичностью. Для биологического использования D-изомеров известно два пути: рацемазы, или эпимеразы, превращают D-аминокислоты непосредственно в L-энантиомер; ферменты, например D-аминокислотная оксидаза (DAAO) и D-аспартат оксидаза (DASPO, или DDO), катализируют окислительное дезаминирование D-аминокислот в α-кетокислоты, которые затем могут специфически аминироваться до L-энантиомера. У млекопитающих преобразование оксидазами преобладает над рацемазами, активными в основном у бактерий. В организме неметаболизированные D-аминокислоты выводятся с мочой.
D-аминокислоты — обычные компоненты нашего рациона. В магазинах продается много товаров, которые содержат значительное количество D-аминокислот: фруктовые соки, крупы, картофель, томатные соусы, молочные продукты и т. д. Во время обработки, обычно проводящейся для улучшения вкуса, консистенции или срока годности, L-аминокислоты частично рацемизуются до D-энантиомеров. D-аминокислоты могут также появляться в результате фальсификации — например, при добавлении дешевых гидролизованных белков в пищевые продукты, чтобы скрыть низкое содержание питательных веществ. Более половины всех молочных и ферментированных продуктов содержат D-аланин, D-аспарагиновую и D-глутаминовую кислоты.
Ежедневно в организм человека может поступать более 100 мг D-аминокислот. Так, в 100 г сыра эмменталь содержится 70–80 мг D-аминокислот, а в 100 мл растворимого кофе — 20 мг.
До сих пор о роли D-аминокислот в пищевых продуктах известно мало, в том числе и потому, что обнаружить их в рацемических смесях достаточно сложно. По этой причине всё большее число исследований посвящено методам качественного и количественного определения D-аминокислоты в продуктах питания.

D-аминокислоты в пище
В последние годы стало известно, что в продуктах содержатся не только широко распространенные L-, но и D-аминокислоты. D-аминокислоты встречаются в свободном или связанном состоянии в естественном виде, например в моллюсках или ферментированных блюдах, либо образуются искусственно при обработке или фальсификации белковых компонентов. D-аминокислоты обладают отличными от L-энантиомеров вкусом и ароматом, а также противомикробным и антивозрастным действием.
D-аминокислоты изначально присутствуют в некоторых растениях, фруктах и овощах. Обычно количество D-аминокислот, содержащихся во фруктах и овощах, ниже 3,4% и 0,7%, соответственно.
Наибольшее количество отдельных D-аминокислот обнаружено в грейпфруте — 3,4% D-аспарагина и 1,9% D-аспарагиновой кислоты, в яблоках — 2,7% D-аланина и 1,7% D-серина, в клементинах — 1,3% D-глутаминовой кислоты. Яблоки «голден делишес» содержат 0,8 мкмоль/кг N-малонил-D-триптофана. В коммерчески доступных фруктовых соках высокое количество D-аланина, порядка 10–42%, может появляться в результате бактериального загрязнения.
Исследователи выделяют по крайней мере три пути, которые ведут к появлению D-аминокислот в растениях, включая овощи и фрукты. Первый процесс подразумевает участие ферментов в синтезе свободных и конъюгированных D-аминокислот через различные метаболические пути. Второй предполагает, что D-аминокислоты образуются неферментативно, в результате реакции L-аминокислот с активными карбонильными соединениями, например в ходе реакции Майяра. В третьем случае предполагается, что D-аминокислоты поступают из экзогенных источников, преимущественно бактерий (то есть главным образом благодаря микоризным взаимодействиям между корнями растений и простейшими грибами), которые служат богатым резервуаром D-аминокислот в связанной с пептидогликаном форме, а также в виде свободных молекул. Растения легко поглощают микробные D-аминокислоты.
Источники D-аминокислот
Ферментация продуктов
Присутствие D-аминокислоты «естественно» для ферментированных продуктов. Они могут находиться в них изначально или образовываться в результате деятельности микроорганизмов. В производстве ферментированных продуктов часто используются спиртовое, уксуснокислое и молочнокислое брожение. Каждое из них вносит свой вклад в образование D-аминокислот. Молочное брожение — основной путь синтеза D-аминокислот. Например, молочнокислая ферментация в основном ответственна за образование высоких концентраций D-аспарагиновой кислоты, D-аланина и D-глутаминовой кислоты в квашеных помидорах, в кефире, йогурте, простокваше и козьем свежем сыре, соевом соусе и т. д., и особенно в пиве, вине и саке. D-аланин, D-глутаминовая и D-аспарагиновая кислоты, D-лейцин и D-изолейцин присутствуют в вине и влияют на его вкус: например, D-аланин сладок. В некоторых случаях количество D-аминокислот, по-видимому, связано с присутствием определенных видов бактерий: при ферментации красного и белого вина увеличение количества D-аланина, D-глутаминовой кислоты и D-лизина хорошо коррелирует с присутствием полезной грамположительной бактерии Oenococcus oeni, осуществляющей яблочно-молочное брожение, конечные продукты которого придают вину специфический вкус и аромат. В последние десятилетия наличие D-пролина в вине использовалось в качестве индикатора при определении возраста, пока другие исследователи не опровергли корреляцию между старением и содержанием D-аминокислоты. Оказалось, что образование D-аминокислот в основном зависит от бактерий, используемых для ферментации. Изменения в составе D-аминокислот во время брожения представляют интерес для виноделов, поскольку связаны со вкусовыми качествами и коммерческой ценностью.
Иногда ферментация необходима для того, чтобы сделать сырье более пригодным для последующей обработки или для придания особых свойств. Например, закваска делает муку пригодной для выпечки, определяет взаимодействие компонентов муки и подавляет размножение нежелательных бактерий или конкурентных дрожжей. Использование молочнокислых бактерий и дрожжей в закваске приводит к образованию в тесте свободных D-аланина и D-глутаминовой кислоты.
Большое количество D-аланина, D-аспарагиновой и D-глутаминовой кислот также присутствует в хорошо выдержанных сырах, например в Parmigiano Reggiano и Grana Padano — до 5 г/кг.
Содержание D-аминокислот варьируется у сортов сыра, а также у каждого сорта в зависимости от стадии производства и созревания.

D-аминокислоты как артефакты производства
Пищевая промышленность выпускает много продуктов, которые содержат значительное количество D-аминокислот: печеный картофель, фруктовые соки и соки с мякотью, сухие завтраки, томатные соусы, молоко и т. д. В них за образование D-аминокислот в основном отвечает рацемизация. Главными факторами, влияющими на рацемизацию, обычно являются щелочные или кислые среды и продолжительность тепловой обработки. Рацемизация также может происходить при комнатной температуре хранения в отдельных продуктах, таких как кимчи или квашеная капуста.
Рацемизация аминокислот наблюдается при приготовлении продуктов, которые обычно содержат низкое количество D-аминокислоты: молоко, мясо и некоторые фруктовые соки. Например, содержание D-аминокислот не увеличивается после кратковременной тепловой обработки, в то время как рацемизация очевидна в стерилизованном или сухом молоке. В этих случаях технологический процесс повышает содержание D-аланина с исходных 3–4% до 12%. В коммерчески доступном молоке повышенное количество D-аминокислот может быть маркером воспалительного заболевания коров-производителей. Так, большее количество D-аспарагиновой и D-глутаминовой кислот, D-аланина и D-алло-изолейцина присутствует в образцах, полученных от коров, страдающих маститом, причем наблюдалась положительная корреляция между увеличением концентрации D-аминокислот и тяжестью заболевания.
Недавнее исследование поведения белка в молочных смесях для детей показало повышенный уровень D-аминокислот как результат термической обработки, необходимой для безопасности и продления срока хранения продуктов. Анализируемые аминокислоты показали различные значения рацемизации: количество D-аргинина, наиболее распространенной D-аминокислоты, увеличилось до 32% от общего количества аргинина. D-метионин может образовываться при готовке пищевых продуктов, а L-фенилаланин и L-тирозин могут быстро рацемизоваться в соответствующий D-энантиомер при щелочной или тепловой обработке. Описано влияние температуры на содержание D-серина и D-треонина в соевом белке. Также сообщалось о влиянии щелочной обработки и высокой температуры на рацемизацию в коммерческих спелых маслинах: после нагревания D-серин и D-аланин показали самые высокие значения трансформации, достигнув 20% и 11% соответственно. Уровни D-серина, D-аланина и D-аспарагина увеличивались в кислых средах.
Интересное исследование, проведенное на пищевых отходах агропищевой промышленности, показало, что увеличение содержания D-аспарагиновой кислоты связано в основном с жесткостью условий обработки, экстремальными значениями pH и температуры, а процентное содержание D-аланина, скорее всего, обусловлено ферментацией, в то время как образование D-глутаминовой кислоты вызвано обоими факторами.
Повышенные температуры вызывают значительное увеличение концентрации D-аминокислот в меде: образцы, подвергшиеся воздействию высоких температур, содержали большее количество D-аминокислоты пропорционально степени нагрева. Рост концентрации D-аминокислот после обжарки и щелочной обработки наблюдался также в какао-бобах. Влияют и другие факторы, например процентное содержание хлорида натрия в ферментированном рыбном соусе. Исследование, проведенное на образцах рыбного соуса с 10% или 20% соли, показало, что чем больше соли, тем меньше образуется D-аминокислот.
Современная пищевая промышленность учитывает возможные риски, связанные с жесткой обработкой белковых продуктов: всё чаще применяются новые биотехнологические процессы, позволяющие избежать экстремальных условий, предпочтение отдается ферментам, работающим при нейтральном значении pH. Теперь гидролизаты соевого белка чаще производятся ферментативным путем. Однако при изготовлении желатина или выделении белков из зерновых или масличных культур, побочных продуктов помола необходимы жесткие условия. Щелочная обработка используется для придания продуктам особой текстуры, например в случае тофу, для очистки фруктов и овощей, а также для приготовления консервированной, сушеной или замороженной рыбы.
D-аминокислоты — маркеры качества продуктов
В целом наличие D-аминокислот в продуктах питания может быть использовано в качестве биомаркера чрезмерной термической и кислотно-щелочной обработки, бактериального загрязнения или воспалительных заболеваний сельскохозяйственных животных. Эти маркеры подходят для оценки качества белка из пищевых отходов агропищевой промышленности, который возможно использовать для других целей. D-аминокислоты — маркеры загрязнения в неферментированных продуктах. Микробное загрязнение способствует увеличению содержания свободных D-аминокислот из-за ферментов микробной рацемазы и лизиса клеточной стенки. Так, если молочные продукты содержат повышенное количество D-аланина, D-аспарагиновой и D-глутаминовой кислот (1–3 мг/л), то это связывают с бактериальной активностью, а не технологиям переработки. Соотношение D/(D+L) в 3–4% трех свободных D-аминокислот принято считать физиологическим значением. Содержание D-аланина в образцах сырого молока увеличивается после хранения при 4 ºC в течение месяца: соотношение D/(D+L) достигает 50–55% при содержании D-аланина 3–5 мг/л. Увеличение количества D-аланина связано с присутствием психротрофных бактерий, способных размножаться при температурах ниже 5 ºC и ухудшающих вкус молока. Поскольку количество D-аланина не связно с технологией обработки молока, то эта D-аминокислота может рассматриваться как индикатор бактериального загрязнения.
Содержание D-аминокислот определено в коровьем, овечьем и козьем молоке: в козьем обнаружено большее количество D-аланина, D-аспарагиновой кислоты и D-лизина, чем в образцах коровьего и овечьего молока.
Анализ козьего молока показал соотношение D/(D+L) аланина в диапазоне 3,5–36,7% по сравнению с 1,2–4,5% для образцов коровьего и 1,2–6,5% для овечьего молока. Эти результаты объясняются более сильным загрязнением козьего молока из-за особенностей животных и менее контролируемых условий хранения.
Значительное количество D-аланина было также обнаружено во фруктовых соках. Грейпфрутовый сок, хранившийся 40 дней, показал увеличение содержания D-аланин до 5–20 мг/л и бактериальное загрязнение, соответствующее концентрации > 107 КОЕ/мл. Как и в образцах молока, содержание D-аланина во фруктовых соках не увеличивалось при пастеризации или стерилизации и в течение срока хранения.
Вкус D-аминокислот
Известно, что D-гистидин, D-лейцин, D-фенилаланин, D-триптофан и D-тирозин имеют сладкий вкус, в то время как соответствующие L-энантиомеры горьки. Это не является общим правилом, но D-аминокислоты зачастую слаще, чем L-энантиомеры. Сладость D-валина, D-фенилаланина и D-триптофана интенсивнее, чем у сахарозы. Алитам (добавка E956, искусственный дипептидный подсластитель, содержащий L-аспарагиновую кислоту и D-аланин) примерно в 2000 раз слаще сахарозы, в 10 раз слаще аспартама и в шесть раз — сахарина. Сильный вкус саке обусловлен D-аланином, а также D-аспарагиновой и D-глутаминовой кислотами. Происхождение этих D-аминокислот связано с активными во время хранения молочнокислыми бактериями.
Известно, что рецепторы сладости проявляют стереоселективность, предпочитая связывать D-аминокислоты. Среди рецепторов горечи, напротив, есть варианты, которые активируются обоими энантиомерами триптофана, тогда как другие — только L-энантиомером. Стереоселективность рецепторов относится и к фенилаланину. Сообщалось, что респираторные грамположительные штаммы Staphylococcus aureus и Staphylococcus epidermidis, играющие роль в хроническом риносинусите, продуцируют D-аминокислоты, которые активируют рецепторы сладкого вкуса TAS1R/2 в одиночных хемосенсорных клетках и ингибируют секрецию антимикробных пептидов.
D-аминокислоты и здоровье человека
Метаболизм D-аминокислот в организме человека до сих пор остается спорным вопросом. У млекопитающих ферменты DAAO и DASPO превращают D-аминокислоты через окислительное дезаминирование в α-кетокислоты. DAAO активен в отношении ряда D-аминокислоты и в основном экспрессируется в печени и почках. Затем α-кетокислоты превращаются в L-аминокислоты. В организме человека рацемизация ограничена несколькими аминокислотами — D-серином и, возможно, D-аспарагиновой кислотой.
Метаболизм D-аминокислот у млекопитающих в большой степени обусловлен микробиотой кишечника. Питательность незаменимых D-аминокислот зависит от формы введения, как свободных аминокислот или как компонентов белка, и от аминокислотного состава — на перевариваемость, использование и выведение любой D-аминокислоты могут влиять другие аминокислоты, присутствующие в рационе. Пептидные связи между D-L-, L-D- или D-D-аминокислотами устойчивы к протеолитическим ферментам, что приводит к снижению перевариваемости и в итоге к образованию олигопептидов с неизвестной биологической активностью. Однако в ходе испытаний парентерального питания взрослых и детей свободными D-, L-аминокислотами не обнаружилось токсичного действия.
Пониженная усвояемость пищевых белков, содержащих D-аминокислоты, в некоторых случаях может оказаться полезной для питания, способствуя значительной потере веса при употреблении в течение нескольких дней. Пищевые продукты, предназначенные для снижения веса, содержат 50% D-серина, 37% D-аспарагиновой кислоты и 26% D-фенилаланина; такое большое количество D-энантиомеров, вероятно, нежелательно при употреблении в качестве единственного источника пищевых белков. D-аминокислоты также отнесены к антипитательным факторам. Если рассматривать конкретные D-аминокислоты, то D-метионин плохо усваивается человеком при пероральном или парентеральном потреблении, а D-тирозин существенно подавляет рост у мышей, так же как D-метионин и D-лизин. В присутствии больших количеств свободных D-аминокислот ферментативная система DAAO насыщается, и поэтому белки, содержащие D-аминокислоты, гидролизуются медленнее, чем состоящие только из L-аминокислот. При этом образуются D-D-, D-L- или L-D-пептиды, которые плохо деградируют под действием протеаз и могут конкурировать с нормальными пептидами за связывание с активным сайтом протеолитических ферментов. Последующая, более медленная по сравнению с L-аминокислотами, адсорбция понижает усвояемость белка.

Что касается потенциального терапевтического применения D-аминокислот, то D-серин предложен для терапии посттравматического стрессового расстройства, а D-фенилаланин — для вызывания анальгезии: пероральный прием 750–1000 мг D-фенилаланина в день ведет к ингибированию карбоксипептидазы, которая участвует в расщеплении опиоидного пентапептида в головном и спинном мозге и связана с повышением уровня энкефалинов в мозге. D-серин изучается как вспомогательное средство для лечения шизофрении.
Некоторые D-аминокислоты демонстрируют противораковые эффекты. Введение D-валина ухудшает питательный статус и ингибирует рост опухоли у крыс с гепатомой по сравнению с нормальной диетой. Ряд D-аминокислот присутствует в антимикробных пептидах. Также предполагается, что протеолитическое расщепление пищевых белков, содержащих D-аминокислоты, приводит к образованию пептидов с антибиотическими свойствами.
О присутствии различных D-аминокислот в роговом слое кожи человека сообщили исследователи из токийской компании Shiseido. Оказалось, что при снижении уровня D-аспарагиновой кислоты в процессе старения ухудшается выработка коллагена. После двухмесячного курса приема D-аспарагиновой кислоты у испытуемых явно увеличилась толщина кожи. Соответственно, компания разработала первый функциональный продукт питания, обогащенный D-аспарагиновой кислотой, под названием Kirei no Susume. Основываясь на том, что D-аланин улучшает выработку ламинина-5 в базальной мембране кожи и при этом его уровень у пожилых людей восстанавливается, та же компания решила выпускать косметику с добавкой D-аланина как антивозрастного фактора.
Кроме того, относительно старения сообщалось, что длительное введение мышам D-аминокислот, например D-серина, улучшает пространственную память в тесте на когнитивные функции и повышает в коре головного мозга уровни 5-гидрокситриптамина и ряда L-аминокислот: аланина, серина, валина и изолейцина. Предполагается, что D-серин отвечает за улучшение пространственной памяти, воздействуя на NMDA-рецепторы. Следовательно, молекулы, выделяемые бактериями, могут влиять на функцию центральной нервной системы. С другой стороны, измененные уровни D-аминокислоты вызывают серьезные повреждения почек грызунов, хотя нефротоксичность можно ослабить различными способами.
Благодаря повышению стабильности пептидов с D-аминокислотами на их основе разрабатывают лекарственные препараты. Так, в Техническом университете Мюнхена при поддержке компании Merck синтезировали и изучают Cilengitide, в состав которого входит D-фенилаланин. Этот пептид взаимодействует с мембранными белками, от которых зависит форма, подвижность, жизненный цикл клетки и формирование новых кровеносных сосудов. Cilengitide исследуется как препарат для лечения глиобластомы. D-аминокислота в аминокислотной последовательности также служит для фиксации конформационного равновесия.
Пептиды, стимулирующие высвобождение гормона роста (GHRPs), — другие синтетические молекулы, которые часто содержат некодируемые D-аминокислотные остатки. Например, разработанный компанией Novo Nordisk ипаморелин несет в себе D-фенилаланин. Препарат не показал эффективности в клинических испытаниях при лечении послеоперационной кишечной непроходимости, но в комбинации с анаболическими стероидами вошел в «аптечку» недобросовестных спортсменов как допинг.
Бремеланотид (Vyleesi, «женская виагра») — пептид c D-фенилаланином от компании Palatin Technologie — первый и пока единственный одобренный FDA препарат для предклимактерических женщин с приобретенным генерализованным сниженным половым влечением или его гипоактивным расстройством.
Являясь производным меланотана II, также содержащего D-фенилаланин, пептид действует и на мужчин, улучшая эрекцию. Бремеланотид в этом отношении эффективен как монотерапия и вызывает синергизм с ингибиторами ФДЭ-5, например с силденафилом.
Синтетический гексапептид даларгин, агонист дельта-опиоидных рецепторов, содержит остаток D-аланина, что отражено в названии. Даларгин получен и исследован в 1980-х годах в лаборатории синтеза пептидов ВКНЦ АМН СССР. Препарат одобрен для применения в России при лечении пептической язвы. Даларгин является аналогом природных метионин-энкефалина и лейцин-энкефалина, в которых глицин замещен на D-аланин, а C-концевая аминокислота — на аргинин. Введение D-аминокислоты здесь направлено на увеличение биологической активности и повышение устойчивости к разрушению в биологических средах. Недавно даларгин, благодаря ранозаживляющим и иммуностимулирующим эффектам, запатентовали как средство лечения тяжелых пневмоний, возникающих из-за коронавирусной инфекции COVID-19.
Еще одна область применения D-аминокислот — это конструирование самособирающихся пептидов, обладающих особыми молекулярными свойствами, обеспечивающими уникальную способность формировать супрамолекулярные (надмолекулярные) структуры. Первый такой пептид обнаружили в 1990 году в дрожжевом белке. На основе самособирающихся пептидов разрабатывают материалы для контролируемого высвобождения лекарств, гидрогели для тканевой инженерии, трехмерные каркасы для клеток тканей, а также полупроводники, цветные красители и покрытия. К перспективным направлениям относятся регенеративная медицина, 3D-культуры клеток тканей и т. д. Дизайн самособирающихся пептидов подразумевает чередование гидрофобных и гидрофильных фрагментов, различных заряженных остатков и использование L- и D-аминокислот. Такой подход позволяет задать конкретную конформацию молекулы. Синтез пептидных единиц завершается самосборкой в подходящей среде. В материалах, предназначенных для медицинских разработок, D-аминокислоты служат для замедления биоабсорбции полученных пептидов и защиты от деградации L-протеазами. Также они обладают контролируемой биодоступностью и улучшенным профилем активности.
Заключение
Несмотря на то, что долгое время лишь L-аминокислоты считались фундаментальными компонентами живых организмов, присутствие и важность «неправильных» D-энантиомеров в настоящее время несомненны. Они не только поступают из естественных источников, но и образуются в продуктах питания при их готовке или ферментации. Что касается влияния D-аминокислот на здоровье человека, с одной стороны, известны примеры их полезных свойств, но с другой — остаются нерешенные вопросы: как именно влияют D-аминокислоты на пищеварение; зависит ли эффект от их введения в свободном виде или как компонента белков; заменяют ли плохо перевариваемые белки с D-аминокислотами пищевые волокна? И какие новые полезные свойства можно найти у «неправильных» молекул?
