Как справиться с бактериями, устойчивыми к антибиотикам? Возможно, с помощью их естественных врагов — вирусов
В 2019 году ВОЗ включила устойчивость бактерий к антибиотиками в топ-10 главных проблем здравоохранения. Действительно, бактерии мутируют, и всё больше штаммов не реагирует на привычные методы лечения. Возникают суперинфекции, и совершенно неясно, как их лечить. Что делать, если человек больше не сможет контролировать бактерии? Возможно, стоит натравить на них естественного хищника — вирусы.
Бактериофаги, или просто фаги — это вирусы, которые избирательно атакуют только бактерии.
Их действительно очень много: если сложить все остальные организмы на Земле (в том числе вымершие), то бактериофаги всё равно выйдут вперед с серьезным отрывом.
Как и все вирусы, бактериофаг состоит из генома, защищенного капсидом, белковой оболочкой. Но, в отличие от других вирусов, которые могут упаковываться в трубочку или икосаэдр, многогранник с 20 гранями, внешняя оболочка у них причудливая — она состоит из «головы» и «хвоста», которые могут быть усеяны такими же белковыми ножками и рожками (их роль крайне важна — этими ножками-ниточками бактериофаг лучше прикрепляется к бактерии). «Голова» фага обычно икосаэдрической формы, но может быть и сферической, внутри нее хранится геном. «Хвост» — полая трубка из белка, может быть длинной, короткой или вообще отсутствовать.
Когда бактериофаг прикрепляется к клетке хозяина, он может выбрать одну из двух стратегий — литическую или лизогенную.
В первом случае задача вируса как можно быстрее нафаршировать бактерию своими копиями, а когда она умрет — выйти на свободу.
Для этого фаг вводит свой геном в цитоплазму бактерии, а ее рибосомы начинают производить вирусные белки вместо своих, бактериальных. Клетке от этого быстро становится нехорошо: ресурсы, необходимые ей для жизни, тратятся на создание новых капсидов и вирусных геномов. Вскоре после ее гибели клеточная оболочка разрушается (лизируется) и миллионы свежесозданных бактериофагов оказываются на свободе, готовясь напасть на другие бактерии.
В случае лизогенной стратегии воспроизводство генома происходит совсем иначе. Вирусные гены тоже попадают в клетку бактерии, но, вместо того чтобы перехватывать управление на себя, они встраиваются в бактериальный геном, могут там жить припеваючи и вовсе не мешая клетке, а она тем временем делает всю работу: она делится, и в каждом ее потомке будут жить новые и новые копии вирусных генов. А уж если одному из этих потомков захочется техасской резни — он без проблем переходит к литической стратегии.
История открытия бактериофагов, как и вирусов, темна и неоднозначна. В 1915 году английский бактериолог Фредерик Туорт описал болезнь бактерий, стафилококков: они становились прозрачными, а при пропускании бактерий через специальный фильтр в отфильтрованной жидкости оставался агент, который мог заразить другую, здоровую колонию. Увы, Туорт только описал такое явление, а в 1917 году французский микробиолог, живущий в Канаде, Феликс Д’Эрелль уже вплотную (и абсолютно независимо) изучит возбудителя болезней бактерий, догадается о его вирусной природе и введет новый термин — бактериофаг. Споры не утихают до сих пор, кто же из них был первооткрывателем?
Д’Эрелль к тому же первым придумал концепт фаговой терапии. Представьте: начало ХХ века, инфекции косят людей налево и направо, а до открытия антибиотиков еще лет десять.
И тут появляется мысль, что раз уж эти вирусы отлично поедают бактерии, почему бы не заразить людей, болеющих бактериальной инфекцией, еще и вирусом?
И это сработало: в 1919 году Д’Эрелль создает фаговый препарат против дизентерии и поит им 12-летнего заболевшего мальчика. После первого же применения симптомы исчезли и мальчик выздоровел. Конечно, эксперимент был абсолютно неэтичным, исследователь действовал наугад, поэтому о результатах Д’Эрелль отчитался только в 1931-м. Однако в 1921 году уже вполне официально сообщается о применении фага против стафилококка, а затем другого — против бубонной чумы, и в 1938-м коммерческие компании (в Европе — L’Oréal, Eli Lily Company в США) начинают производство препаратов на основе бактериофагов. До открытия пенициллина бактериофаги были единственным способом борьбы с бактериями.
Когда Д’Эрелль работал в Институте Пастера в Париже, с ним познакомился Георгий Элиава, молодой грузинский микробиолог. Он сразу проникся идеями фаговой терапии и, уже вернувшись в СССР, продолжил эти исследования. Элиава открывает Бактериологический институт в Тбилиси (потом его переименовали в Институт вакцин и сывороток). Там были созданы условия для производства огромного количества фаговых «коктейлей», пригодных для терапии и профилактики в медицине и ветеринарии. В пик расцвета в институте работало более тысячи исследователей и ежедневно выпускалось несколько тонн фаговых препаратов. Ими лечили кишечные заболевания, стафилококковые инфекции, абсцессы. К тому времени Феликс Д’Эрелль, уже успевший пожить в Китае и Америке, тоже перебирается в Грузию. На территории института для него даже строят отдельный коттедж. Д’Эрелль и Элиава вместе ведут исследования, но недолго: в 1937 году Георгия Элиаву арестовывают и расстреливают как «врага народа». А Д’Эрелль спешно возвращается во Францию.
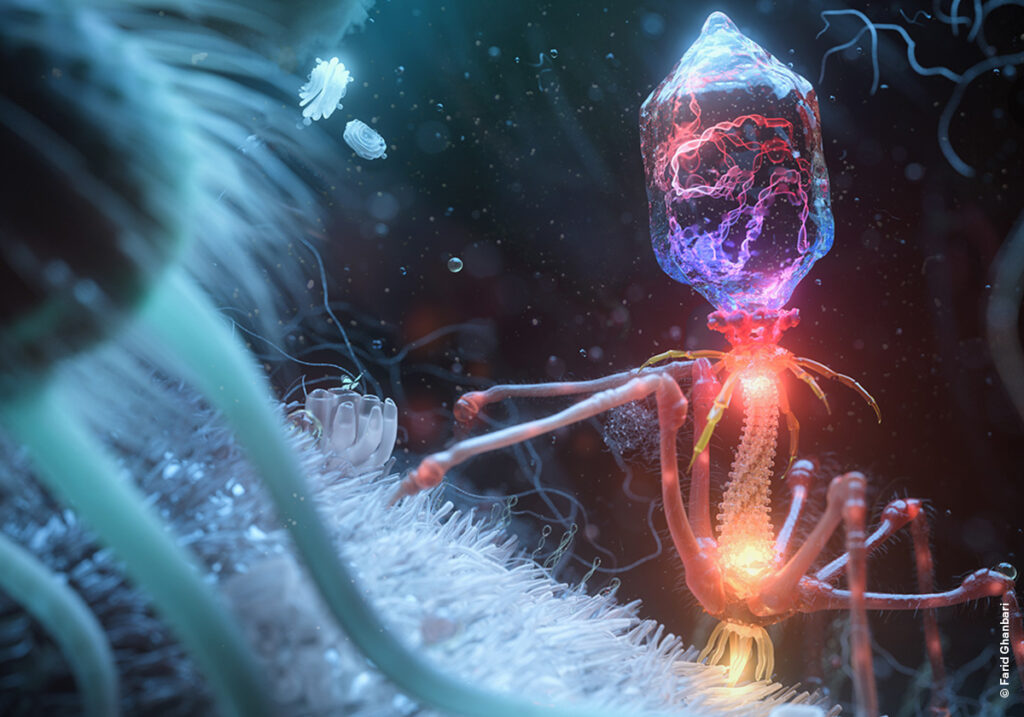
Несмотря на смерть Элиавы, Бактериологический институт в Тбилиси остается мировым лидером по изучению бактериофагов и производству препаратов на их основе. Правда, отчасти из-за того, что Европа и США переключились на антибиотики: их было легче синтезировать, хранить, и они обладали широким спектром (а одна из проблем бактериофагов как раз была в том, что каждой бактерии — личный убийца). Стало ясно, что в разработке антибиотиков СССР уже не догонит западные страны, так что здесь решили продолжать свои исследования.
Они действительно были впечатляющими: в 1936 году на основе фагов Магдалина Покровская создает первую живую вакцину против чумы (проводя испытания на себе), а в 1942-м в осажденном Ленинграде Зинаида Ермольева налаживает массовое производство холерного бактериофага.
Это был не первый ее опыт: до отправки в Ленинград Ермольева первая в СССР получила пенициллин и успела наладить его распространение.
После Второй мировой войны отношения между СССР и Западом окончательно рушатся и интерес западных ученых к бактериофагам не только угасает, но и подвергается осуждению. Как в целом и любой интерес к советской науке. Фаговую терапию объявляют «научно несостоятельной», западные исследователи публикуют статьи о ее опасности. Клинические испытания фаговых препаратов проводят в основном в СССР — и бактериофаги успешно уничтожают возбудителей дизентерии, брюшного тифа, очищают гнойные язвы. Проводят единичные исследования в других странах — Бразилии, Польше, но всё же применение бактериофагов остается типично советской историей. В Европе и США фаговая терапия одобрена так и не была, хотя успешно и на законных основаниях работала в пищевой промышленности — для контроля патогенных организмов.
К 1970-м годам окончательно исчезают коммерческие фаговые препараты, большая фарма полностью переключается на антибиотики. Ими лечили всё, даже — совершенно бесполезно — вирусные заболевания. К 1980-м антибиотики настолько хорошо справлялись с инфекциями, что фармацевтические компании постоянно увеличивали темпы их производства, игнорируя другие пути терапии и вместе с тем выделяя недостаточно финансирования на разработку новых антибактериальных препаратов. Совокупность всех этих факторов (от устаревших лекарственных форм до неправильного их применения) и привела нас к тому, что бактерии стали устойчивыми к антибиотикам. Возникли суперинфекции, которые не поддаются лечению обычными лекарствами. Более того, ученые ищут новый путь, новое вещество, изучают его, хранят в секрете от бактерий и всё равно находят микроба, который уже устойчив к этому открытию. Более 35 000 смертей в год происходят из-за таких супермикробов. Необходимо разрабатывать новые вещества, которые, например, будут по-особому нарушать метаболизм бактерий, или искать новые, хорошо забытые старые, пути решений. Так, к началу 2000-х исследователи вновь вспомнили о бактериофагах и концепте фаговой терапии.
К 2021 году опубликованы данные об успешных случаях лечения больных с суперинфекциями: выздоровление от некротического панкреатита, очищение инфицированных трансплантатов, лечение пневмоний. Параллельные исследования in vitro тоже показывают эффективность этого метода. И всё же до сих пор недостаточно исследований для окончательной легализации бактериофагов: неизвестно, существуют ли бактерии, устойчивые к заражению фагами, как организм человека будет реагировать на вирус (или его остатки) уже после терапии и много других нюансов, связанных с сопутствующими процессами.
В целом в России сейчас зарегистрировано более десяти фаговых препаратов для применения в разных формах. Существуют даже косметические гели с фагами.
В остальном мире применение бактериофагов в медицине в той или иной степени допускается. Прямо сейчас проходят несколько глобальных клинических испытаний фаговых препаратов против синегнойной и кишечной палочек, и, вероятно, по их окончании такие препараты будут одобрены к применению. Пока же фаги применяют в пищевой промышленности и в ветеринарии.
Другое дело, что бактериофаги могут послужить ученым и в другом ключе. Например, их можно использовать как переносчиков необходимых генов, в частности для редактирования генома бактерии. Цель — не просто уничтожить бактерию, а нарушить в ней гены устойчивости к антибиотикам. Раствор таких фагов можно наносить на поверхности в больницах, чтобы избежать появления суперинфекций. А в 2018 году исследователям Джорджу Смиту и Грегу Уинтеру было присуждено 2/3 Нобелевской премии по химии за метод изучения белковых и ДНК-белковых взаимодействий с помощью бактериофагов. Благодаря быстрому копированию фагов можно встроить в них любую генетическую последовательность, размножить ее хоть до миллиона копий и изучить, как станет меняться и она, и белки, которые ее мутировавшие копии будут кодировать. И, разумеется, фаги могут быть отличным индикатором жизнеспособности бактерий — ведь существовать они могут только в живых клетках.
