Вы не знаете, сколько вам лет. Что такое «часы старения» и как ученые определяют биологический возраст человека
Мы часто слышим, что в XXI веке люди стали жить дольше благодаря современной медицине и технологиям. Действительно, в развитых странах средняя продолжительность жизни доходит до 80 лет. Но сохраняется ли ее качество на высоком уровне? Исследования говорят, что скорее нет. Продолжительность здоровой жизни практически не растет, в то время как население с огромной скоростью стареет. Над продлением жизни работают многие ученые: разрабатывают фармацевтические препараты, создают модели старения, изучают методы предотвращения болезней пожилых. Однако это не единственное, что может нам помочь. Биолог Светлана Бозрова рассказывает о том, как ученые измеряют биологический возраст, чтобы лучше бороться с дефектами старости.
Чтобы научиться «лечить» старение, необходимо правильно определять биологический возраст организма. Что такое хронологический возраст — всем известно. Нельзя ли просто считать, что сколько человек прожил — такой у него и биологический возраст? Оказывается, нет.
Биологический возраст — уровень функционирования организма, органа или клетки, оцениваемый по сравнению с ожидаемым для хронологического возраста. Эти два параметра отнюдь не всегда равны друг другу. Именно поэтому существует такое понятие, как «возрастная разница» (age gap) между реальным возрастом человека и ожидаемым биовозрастом.
Для того, чтобы определить биологический возраст, ученые используют молекулярные биомаркеры. Они отражают состояние клеток, тканей, органов (например, сердца или мозга) или всего организма и необходимы для разработки лекарств, направленных против старения.
Старение происходит сразу на многих уровнях организма и затрагивает все системы. Из-за этого маркеров может быть бесконечное множество: начиная от видимых (поседения, когнитивных нарушений), заканчивая молекулярными биомаркерами (длина теломеров, белки воспаления).
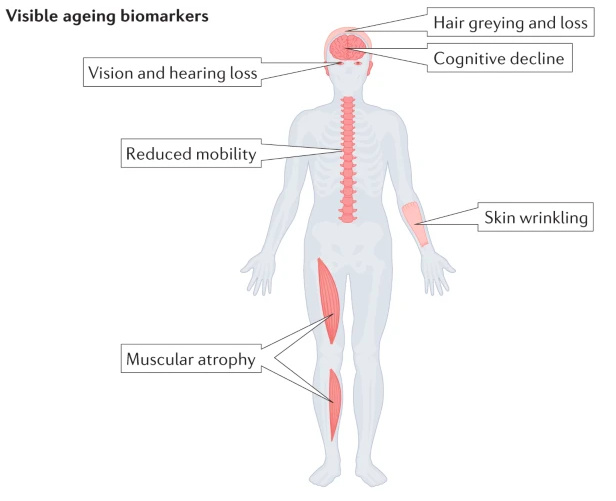
С развитием омиксных технологий обилие возможных биомаркеров старения увеличилось в разы. На их основе можно построить довольно точные «часы старения», которые охватывали бы максимальное количество измеряемых параметров.
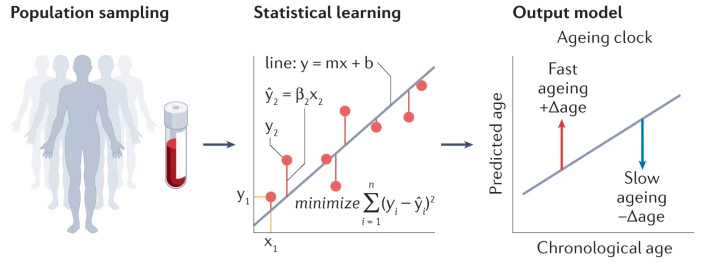
Такая модель обычно строится на линейной регрессии. Суть довольно проста: с помощью анализа образцов от выборки изучаются взаимосвязи между молекулярной характеристикой (например, уровнем экспрессии белка) и зависимой переменной (возрастом). Полученные данные затем используются для прогнозирования возраста, а разница между хронологическим и прогнозируемым возрастом характеризует биологический.
Началась история моделирования часов старения с разработки технологии РНК-секвенирования в 2008 году. Несколько работ, опубликованных на эту тему, открыли дорогу омиксным технологиям. В 2011 году научному сообществу были представлены первые часы, основанные на метилировании, а через два года — эпигенетические часы Хорвата и Ханнума. Затем были разработаны также и транскриптомные, митотические и протеомные часы.
Сейчас в разработке находятся уже более продвинутые версии часов старения, с помощью которых можно предсказывать риск развития сердечно-сосудистых заболеваний.
Конечно, в идеале хорошо было бы построить такую модель, которая точно предсказывала бы начало возрастных изменений, старческих заболеваний и даже конец жизни. Ученые пока что далеки от этого, но уверенно движутся в правильном направлении. Посмотрим, какие направления омиксных технологий помогают им в этом.

Эпигеномика
Изменения в эпигеноме — один из двенадцати основных признаков старения, описанных в легендарной статье Карлоса Лопес-Отина.
Самая распространенная модификация ДНК — метилирование, то есть присоединение метиловой группы вместо молекулы водорода. Измерение биологического возраста фокусируется на оценке уровня метилирования цитозина в CpG динуклеотидах — особых регуляторных областях ДНК.
Первые эпигенетические часы были предложены Боклэндтом в 2011 году. На этом же принципе основаны и эпигенетические часы Ханнума и Хорвата, о которых мы говорили выше. Появляются новые усовершенствованные версии этой модели.
Измерения таких часов строятся на основе линейной регрессии и имеют довольно высокую точность. Отдельное преимущество заключается в том, что они одинаково хорошо замеряют биологический возраст любой ткани — неважно, клетки крови исследуют ученые или же печени.
С помощью часов Хорвата исследователи замерили возраст раковых тканей — и он оказался выше возраста основного организма.
Однако риск смертности, который используется в качестве меры «глобального» биологического возраста, в целом был довольно слабо связан с показаниями эпичасов. Это поднимает вопрос о том, какая биология вообще в данном случае измеряется. Есть версия, что на результаты работы эпигенетических часов очень сильно влияет работа клеток крови. Однако корректировка по этому параметру пока что не привела к особым успехам.
Когортное исследование выявило парадоксальную вещь — чем аккуратнее мы измеряем уровень метилирования, тем хуже прослеживается корреляция между риском смертности и показаниями эпигенетических часов.
Оставлять работу над эпигенетическими часами ученым не хотелось, и они предложили их усовершенствованную версию — эпичасы второго поколения, которые должны проводить более релевантные измерения. В 2016 году в Китае разработали первые такие часы. Они основывались на подсчете количества делений клетки. Для «снятия показаний» с этих эпигенетических часов была разработана специальная математическая модель.
Авторы основывались на знании, что гиперметилирование определенных участков ДНК стволовых клеток связано с количеством их делений. Модель натренировали на данных сравнения активности этих участков у плода и у взрослых людей. Такое решение помогает сконструировать биологические часы, нацеленных именно на измерение степени старения.
Нельзя не упомянуть часы под названием DunedinPoAm DNAm. Они уникальны тем, что для тренировки этой модели использовались лонгитюдные данные.
Ученые проводили забор материала у людей одного года рождения в их 26, 32 и 38 лет. Затем модель тренировали на определение возраста по классическому методу с метилированием ДНК. Обычно же для исследований используют когортные данные: берут несколько групп разных возрастов и сравнивают их между собой.
Такие часы оказались гораздо лучше всех предыдущих версий: они имели высокий уровень ассоциации показаний с возрастными фенотипами, включая физическое функционирование, когнитивный статус и смертность.
Основной недостаток эпигенетических часов в том, что мы до сих пор не знаем, в чем физиологический смысл метилирования определенных участков ДНК — нам известен лишь сам факт. Тем не менее они имеют очень много плюсов: высокую воспроизводимость результатов и отсутствие зависимости показаний от типа ткани. Конечно, нельзя назвать их совершенными, но в качестве клинических биомаркеров использовать их уже можно.
Транскриптомика
Если вы заглянете в «Википедию», то увидите там определение: «Транскриптом — это совокупность всех транскриптов, синтезируемых одной клеткой или группой клеток, включая мРНК и некодирующие РНК». Транскрипты, или матричная РНК (мРНК), — промежуточное звено между ДНК и белком. Упомянутая далее РНК носит в большей степени регуляторную функцию.
Зная, что за транскрипты синтезируются в клетке, мы можем судить о генетическом коде, с которого они считываются. Поэтому транскриптомные часы гораздо ближе к генам, чем эпигенетические. Первые такие часы были созданы в 2015 году на основе данных об экспрессии генов в клетках крови. Несмотря на то, что объем данных для обучения модели был набран внушительный, точных часов не получилось. Из-за технических особенностей данные имели слишком большой разброс. Однако учесть некоторые интересные параметры, например статус курильщика или систолическое давление, при расчете риска смертности ученым все же удалось. И это — важное преимущество транскриптомных часов перед эпигенетическими.
Работы по усовершенствованию системы продолжались, и в 2018 году была предложена новая модель. На данных, полученных с клеток кожи при помощи линейной дискриминантной модели, удалось разработать систему, которая довольно точно работала. Однако она пока что не протестирована на больших объемах данных, поэтому для клинической практики еще не годится.
Новое слово было сказано два года назад: для создания транскриптомных часов ученые из Германии предложили использовать нейронные сети.
Искусственная нейронная сеть значительно повысила интерпретируемость данных, которые раньше оставались для нас просто черным ящиком. Ученые утверждают, что их часы основываются на показателях биологического старения кожи, и проверка модели in silico показала высокую точность их работы.
Транскриптомные часы — довольно перспективное направление. Но из-за отсутствия масштабных исследований и тестирования разработанных моделей на больших объемах данных очень трудно судить об их реальной прогрессивности.
Протеомика *
* Область молекулярной биологии, посвященная идентификации и количественному анализу белков. Протеом — совокупность всех белков организма.
У человека в организме содержится около 50 тыс. белков — логично, что ученым пришла в голову идея измерять возраст по их составу. Методы протеомики — масс-спектрометрия, иммуннохимия и другие — развиваются с огромной скоростью. Бонусом идет доступность биоматериала: методы забора плазмы крови и цереброспинальной жидкости уже давно хорошо отработаны.
В 2018 и в 2019 годах ученые предложили модели протеомных часов, которые основывались на стандартных методах. Они наблюдали за взаимосвязью протеома со многими физиологическими и клиническими фенотипами старения, включая физическое функционирование, результаты когнитивных тестов и маркеры клинической химии. Исследователи показали корреляцию показаний часов со смертностью, заболеваемостью, продолжительностью здоровой жизни и общей продолжительностью жизни.
Десятки белков плазмы крови, проанализированных часами протеомного старения, напрямую регулируют продолжительность жизни. Сотни — имеют биологическую связь с состоянием различных органов. Особенно удобно, что в крови находятся белки, участвующие в работе разных органов и клеток, поэтому можно прицельно сфокусироваться на старении какой-то определенной ткани.
Кроме того, протеомные часы напрямую связаны с двенадцатью признаками старения Лопеса-Отина. Нарушение протеостаза и регуляции питательных веществ, изменение межклеточной коммуникации и клеточное старение — одни из важнейших возрастных маркеров.
Казалось бы, чудо-часы — бери да пользуйся! Но у протеомных часов есть и свои ограничения.
Например, их работа зависит от функционирования почек, а этот параметр в модели пока что учесть не удалось. К тому же полный протеом исследователи пока что тоже не охватили. При этом методы протеомики гораздо новее методов геномики: из-за этого оценка функционирования белков пока что не такая точная, как генов. Поэтому работы тут еще очень много.
Метаболомика *
* Научное изучение химических процессов, включающих метаболиты, низкомолекулярные субстраты, промежуточные продукты и продукты клеточного метаболизма.
Другой подход к использованию доступного материала — измерение уровней метаболитов. С помощью ядерно-магнитного резонанса ученые определили, появление каких веществ в плазме крови свидетельствует о повышенном риске смертности.
Исследования больших групп пациентов выявили метаболический профиль, связанный с риском развития сердечно-сосудистых заболеваний и смертности. Ученые разработали метаболомные часы, которые, основываясь на показателях плазмы крови и мочи, предсказывали бы довольно большое количество событий: от смертности до психологического состояния человека.
Но у метаболомного подхода, увы, оказалось много минусов.
Во-первых, с помощью метаболомики сложнее предсказать риск смерти — корреляция с этим параметром тут гораздо хуже, чем у эпичасов или транскриптомных. Во-вторых, некоторые метаболиты могут присутствовать в одних образцах от одного пациента, но отсутствовать в других — это делает данные очень неточными. А еще, хотя для создания метаболомных часов было обработано огромное количество данных (эти исследования довольно дешевы), внутригрупповая разница между результатами все равно оказалась слишком велика, чтобы четко судить о биологическом возрасте конкретного организма.
Поэтому, хоть метаболомика и перспективный инструмент для изучения старения, с метаболомными часами ученым следует быть очень аккуратными.
Гликомика
Гликом — совокупность всех углеводов в организме. Или, говоря более научным языком, — набор сахаров организма, как свободных, так и присутствующих в более сложных молекулах.
Да, оказывается, по сахарам тоже можно определять возраст! Например, исследователи обнаружили связь между молекулами углевода на одном из наших иммуноглобулинов с некоторыми параметрами старения.
Помимо корреляции с риском смертности, состав гликома взаимосвязан и с метаболическими нарушениями. Все это, конечно, требует дополнительных исследований, но гликомика может очень помочь исследователям при разработке комплексных биологических часов.
Микробиомика
Только ленивый исследователь не попытался связать бактериальный состав организма с его общим здоровьем. У ученых не вызывает сомнений, что у долгожителей особый состав микробиома: определенные микроорганизмы и их метаболиты как будто бы помогают людям жить дольше и здоровее.
Кажется, что вот она, разгадка часов биологического возраста — надо всего лишь знать, какие бактерии обитают в человеке. Однако все не так просто. Эта область науки молода — нужно проводить еще очень много исследований на больших объемах данных.
Первые результаты уже есть: известно, что бактериальный состав больных диабетом первого типа делает их фенотип соответствующим большему возрасту, чем их хронологический.
Путешествуя во времени
Конечно, исследователи разных стран анализируют, какие из разработанных биологических часов лучше, и сравнивают их между собой. Картина получилась своеобразная.
Оказалось, что корреляция показаний между разными часами довольно низкая. Эпигенетические часы имеют большую точность при прогнозировании смертности, а транскриптомные, протеомные и метаболомные — лучше предсказывают развитие возрастных заболеваний.
Кажется очевидным решение проблемы — надо объединить все омиксные данные в одну большую систему и построить модель, обученную на них.
Но это не так просто. Во-первых, разные омиксные данные отражают разные биохимические и физиологические процессы. Во-вторых, на данном этапе развития технологий ошибка между разными исследованиями будет слишком велика, чтобы без потерь в качестве объединить их результаты.
Ученым предстоит еще работать и работать, но как манит результат этих трудов!
Биологические часы будущего могли бы выбирать для измерения любой из аспектов старения: общий возраст организма (чтобы предсказать, например, смертность) или возраст сердца, легких, мозга (чтобы получить более глубокое представление о конкретных заболеваниях). Часы старения — будущее персонализированной медицины и основной навигатор исследований, направленных на увеличение продолжительности здоровой жизни.
