Сработать на опережение. Успехи российской онкологии в ранней диагностике и лечении рака
В 2023 году в России от злокачественных новообразований умерло более 280 тысяч человек. Чтобы изменить эту печальную статистику, требуется совершенствование системы скрининга и методов лечения онкологических заболеваний. Рассказываем, как развивается российская онкодиагностика с применением технологий машинного обучения и искусственного интеллекта, а также над какими перспективными препаратами против рака работают отечественные ученые и медики.
Внедрение ИИ в диагностику онкозаболеваний
Прогноз онкопациентов во многом зависит от ранней диагностики рака. С этим в России большие проблемы: в прошлом году почти четверть случаев рака были диагностированы во II стадии заболевания, 16,4% — в III стадии, 18,9% — в терминальной.
Улучшить ситуацию можно с помощью внедрения технологий машинного обучения в систему скрининга и диагностики злокачественных новообразований, способных с высокой точностью верифицировать рак. В 2020 году в Москве стартовал эксперимент по использованию ИИ для анализа медицинских изображений, полученных во время лучевой диагностики. Он включает в себя десятки направлений, в том числе выявление онкозаболеваний, в частности поиск признаков рака легкого.
ИИ снизил загруженность рентгенологов-диагностов на 86%. Более того, он давал более точные результаты, чем четыре из пяти опытных врачей.
В 2024 году в рамках этого проекта планируется опробовать применение ИИ для выявления признаков рака молочной железы на маммографических снимках и злокачественных новообразований прямой кишки на МРТ-изображениях. Кроме рака, возможности ИИ тестируются в диагностике туберкулеза, тромбоэмболии легочной артерии, ишемического инсульта, рассеянного склероза и других тяжелых заболеваний.
Низкодозовая КТ — самый точный метод скрининга рака легких. Давно доказано, что флюорография и рентгенография грудной клетки не являются скринингом злокачественных новообразований легких и не снижают смертность от них. Ежегодное прохождение низкодозовой КТ уменьшает риск смерти от рака легких на 20–24%. При ежегодном обследовании в течение 5–10 лет этот показатель возрастает до 58%.
Кроме рака легких, низкодозовая КТ способна выявлять и многие другие патологии, включая аневризму аорты, эмфизему легких, атеросклеротическое поражение коронарных артерий.
В эксперименте также тестируются инновационные алгоритмы, нацеленные на диагностику сразу нескольких патологий. Например, разработка российской компании IRA Labs способна на основании анализа одного КТ-изображения диагностировать 14 заболеваний и выявить более сотни лучевых биомаркеров.
Российское общество онкомаммологов провело масштабное исследование, в котором оценивалась способность ИИ выявлять РМЖ. В рамках проекта у 8030 пациенток были проанализированы маммографические снимки. Исследователи заключили, что ИИ не выдает ложноотрицательных результатов, в разы сокращает работу врача-рентгенолога и значительно повышает точность диагностики.
Искусственный интеллект выявил РМЖ у 1,2% пациенток, частота обнаружения рака без применения ИИ была в 6 раз ниже.
Пропуск РМЖ врачом-рентгенологом — довольно распространенная ситуация, которая связана с невнимательностью, малоопытностью врачей, а также с особенностями структуры молочной железы некоторых пациенток. Например, диагностика РМЖ затруднена при преобладании фиброзно-железистого компонента над жировой тканью. Фиброзно-железистая ткань плохо пропускает рентгеновское излучение, что ухудшает визуализацию. Избежать ошибки можно «двойным чтением» маммограмм, когда два независимых врача анализируют снимки. В нашей стране рентгенологи и так перегружены, поэтому вводить «двойное чтение» в стандарт выполнения маммографии — не вариант. Внедрение ИИ в систему скрининга РМЖ позволит повысить качество диагностики без увеличения трудозатрат: при использовании технологий машинного обучения примерно в половине случаев не требуется участие врача-рентгенолога.
На XXVII Российском онкоконгрессе представили модуль с нейронной сетью, встраиваемый в эндоскопическую стойку. Эта разработка поможет врачам при проведении колоноскопии выявлять ранние признаки колоректального рака, который занимает третье место в мире по заболеваемости. Нейронная сеть в режиме реального времени определяет тип, размер, стадию опухоли, выдает предварительный диагноз и предлагает протокол дальнейшего обследования.
Колоноскопия — основной метод скрининга рака кишечника. Она проводится каждые 5–10 лет начиная с 45-летнего возраста. Во время диагностики врачи могут обнаружить полип, который должен сразу удаляться и отправляться на гистологию. Большинство опухолей кишечника формируются из полипов.
Еще один метод скрининга колоректального рака — определение скрытой крови в кале.
Искусственный интеллект способен не только с высокой точностью верифицировать рак, но также сокращать лучевую нагрузку на организм во время исследования и оценивать вероятность озлокачествления диагностических находок.
Ожидается, что в 2024 году в систему здравоохранения каждого российского региона будет внедрено не менее трех диагностических решений на основе ИИ.
Инновационные российские препараты
Для разрушения раковых опухолей активно применяются радионуклеидные препараты. В России их разработкой и внедрением в клиническую практику занимается НМИЦ радиологии Минздрава, объединяющий три крупных медицинских центра. На сегодняшний день на базе НМИЦ создано и тестируется более десятка лекарственных средств против нейроэндокринных злокачественных новообразований, рака яичников, меланомы и других онкозаболеваний.
Несколько лет назад ученые научного центра проводили клинические испытания препарата для лечения кастрационно-резистентного рака предстательной железы — злокачественных опухолей простаты, не поддающихся хирургическому лечению и/или стандартной гормонотерапии.
70% пациентов ответили на лечение. У половины испытуемых после пяти недель терапии уровень ПСА снизился на 50%, что указывает на выраженный терапевтический эффект.
К инновационным методам лечения онкозаболеваний относится иммунотерапия рака с помощью ингибиторов иммунных контрольных точек (ИКТ), которые блокируют определенные рецепторы на поверхности Т-клеток и злокачественных клеток. Эта методика улучшает работу иммунной системы и усиливает противоопухолевый иммунный ответ. Ингибиторы ИКТ произвели революцию в лечении рака и стали предпочтительным методом терапии многих видов злокачественных опухолей.
В российской онкопрактике все чаще применяются препараты класса ИКТ отечественного производства, которые по фармакологическим свойствам и другим показателям ничем не уступают зарубежным аналогам. В частности, в декабре 2022 года в России получил регистрацию отечественный препарат с моноклональным антителом пембролизумаб. Он был успешно протестирован в клиниспытаниях с участием пациентов с меланомой, немелкоклеточным раком легкого, почечно-клеточным раком, раком эндометрия, шейки матки. Его разработка позволит значительно расширить доступ онкопациентов к таргетной терапии.
В последние годы во многих клиниспытаниях было продемонстрировано, что наиболее эффективный способ лечения метастатической меланомы — комбинированная иммунотерапия (применение ингибиторов ИКТ с несколькими моноклональными антителами). Российские ученые создали препарат с содержанием нурулимаба и пролголимаба. В клиническом исследовании OBERTON с участием 117 пациентов с меланомой III/IV стадии была доказана способность препарата значительно увеличивать выживаемость без прогрессирования рака (ВБП).
В группе BCD-217 показатели ВБП за два года составили 41%, в группе, получавшей ингибитор ИКТ с одним моноклональным антителом — 25,4%.
Популярная научная тема — онкобиотики, то есть пробиотические штаммы, способные противостоять раку. Например, пробиотик CBM588 значительно повышает эффективность иммунотерапии онкозаболеваний. В исследовании с участием пациентов с метастатической карциномой почки включение CBM588 в схему иммунотерапии почти в три раза увеличило частоту ответа на лечение и в пять раз повысило выживаемость без прогрессирования рака.
Прорывной метод лечения рака мозга
В начале XXI века российские и американские ученые осваивали лазерную гипертермию и пытались ее применять для лечения раковых опухолей мозга. Методика относится к малоинвазивной хирургии: в опухоль через оптоволокно поступает лазерная энергия, разрушающая злокачественные клетки. Из-за большого количества противопоказаний и высокого риска развития осложнений технология не получила широкого распространения и на время была забыта. Сегодня в России она опять возрождается, но в усовершенствованном, более безопасном варианте.
Автор новой методики — врач-нейрохирург, кандидат медицинских наук О. В. Острейко. Его командой получен патент на способ лечения глиом — опухолей, поражающих глиальные клетки мозга. Апробация малоинвазивной лазерной гипертермии на 50 пациентах с глиомами продемонстрировала высокую эффективность и безопасность.
В группе пациентов с рецидивирующими глиобластомами выживаеость составила 26 месяцев, что почти в два раза больше статистического показателя.
Так как оперативное вмешательство относится к атравматичным и не требует трепанации черепа, пациент становится активным уже в день операции и довольно быстро выписывается из больницы. Сейчас разработчики методики продвигают идею о ее включении в стандарты лечения глиом.
Перспективная методика уничтожения солидных опухолей
Четверть века назад ученые нашли способ превращать Т-лимфоциты (Т-клетки) в «убийц» раковых опухолей. Иммунные клетки, извлеченные из крови онкопациента, подвергаются генноинженерной модификации: на их поверхности вместо обычных белков-рецепторов оказываются химерные антигенные рецепторы (CAR). Перепрограммированные Т-лимфоциты размножают до нужного количества и вводят обратно в организм больного. CAR наделяют Т-клетки способностью распознавать определенные опухолевые антигены и уничтожать определенный тип опухолей.
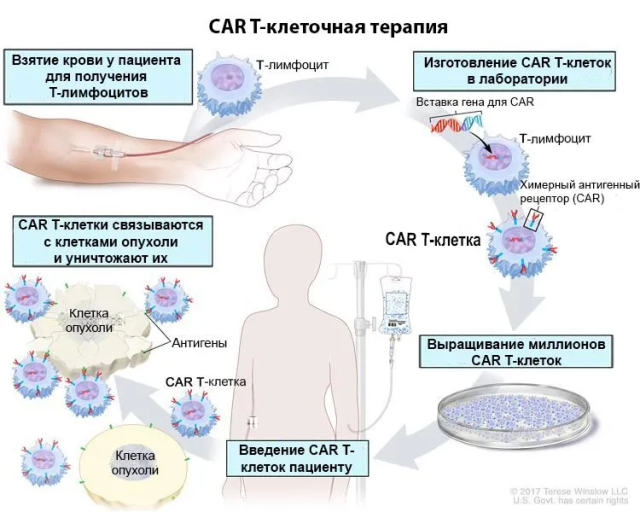
Эта методика успешно применяется для лечения гемобластозов (лейкозов, злокачественных лимфом), однако ее лечебный потенциал в отношении солидных (твердых) опухолей ограничен:
- В солидных опухолях часто образуется аномальная сосудистая сеть, которая не дает CAR Т-лимфоцитам добраться до раковых клеток.
- Разные типы солидных опухолей и злокачественные клетки в пределах одной опухоли могут выделять различные антигены, что затрудняет выбор подходящей мишени для CAR Т-терапии.
- Здоровые ткани могут экспрессировать те же белки, что и опухоли. В итоге CAR Т-лимфоциты атакуют как злокачественные, так и здоровые клетки. Это вызывает осложнения, в том числе смертельные.
Российским ученым удалось преодолеть эти барьеры. На базе Научного центра рентгенорадиологии разработано два высокотехнологичных лекарственных препарата против солидных опухолей. В настоящее время полностью завершены их доклинические испытания. Весь цикл создания препарата от момента взятия биоматериала до получения CAR Т-лимфоцитов с нужными свойствами составляет 2–3 дня. Одна из методик позволяет трансформировать Т-клетки пациента в убийц опухолей, экспрессирующих СА125-белок, который присутствует на поверхности большинства клеток рака яичника.
Ежегодно в мире более 225 тыс. женщин становятся жертвами рака яичника. Несмотря на весомые подвижки в диагностике заболевания, в 75% оно обнаруживается на продвинутых стадиях. 5-летняя выживаемость при 3 стадии составляет 24%, при последней — 4,6%.
По мнению ученых центра, разработанные технологии способны значительно улучшить эффективность лечения рака яичников, а также других солидных опухолей. Доклинические исследования доказали их избирательное воздействие на злокачественные клетки и безопасность для здоровых тканей, способность значительно увеличивать выживаемость, мощный противоопухолевый эффект. В частности, применение CAR Т-терапии в три раза увеличивало апоптоз клеток рака яичника. Ожидается, что в скором времени препараты будут внедрены в клиническую практику.
Вирусы против рака
Более ста лет назад в научных кругах начала появляться информация об умении некоторых вирусов убивать рак. Например, в 1896 году был описан случай временной ремиссии острого лейкоза после заражения пациентки гриппом. В середине прошлого века стали проводиться испытания онколитической вирусотерапии. В одном из них 30 пациенток с карциномой шейки матки лечили различными серотипами аденовируса. У 65% испытуемых наблюдалась регрессия заболевания.
В современных исследованиях вирусотерапии рака используются как естественные, так и генетически модифицированные вирусы. На основе последних создаются противоопухолевые препараты. За рубежом некоторые из них были одобрены для лечения рака. Например, в 2015 году FDA одобрило T-VEC — генетически модифицированный вирус герпеса, предназначенный для лечения меланомы.
Некоторые российские ученые тоже смотрят в сторону вирусотерапии рака. Например, новосибирская компания «Онкостар» разрабатывает противоопухолевые средства с генетически модифицированным вирусами. Ученые создали препарат на основе рекомбинантного штамма вируса осповакцины для лечения рака молочной железы. По словам разработчиков, три года назад им удалось получить одобрение Минздрава на проведение клиниспытаний с участием пациенток с РМЖ. В этом году они надеются начать клиническое исследование с участием больных раком головного мозга, так как вирусный препарат способен убивать и клетки глиом.
