Темные аллели: как гены определяют исход лекарственной терапии и может ли антидепрессант заставить человека убивать?
Разработкой флуоксетина в 1970-х занималась компания «Эли-Лилли». Он появился в продаже под торговым названием «Прозак» в 1988 году, а к началу 90-х стал мировым лидером на рынке антидепрессантов. Новый модный препарат принимали многие известные люди. Так, например, в 1994-м он был прописан принцессе Диане. Считалось, что прозак способен сделать робких уверенными, впечатлительных — стойкими, превратить интроверта в экстраверта, а пессимиста в оптимиста. На пике популярности, в середине 90-х, его, словно панацею, старались прописать каждому по показаниям и без. 18-летний американец Курт стал одним из таких пациентов.
По словам матери, Курт оставался добрым и общительным парнем, несмотря на то, что в последнее время у него беспричинно ухудшилось настроение. Врач общей практики пренебрег консультацией психиатра и не подтвердил тип депрессии с помощью диагностического теста — просто назначил парню прозак.
В первые дни терапии его поведение резко изменилось: из приветливого и общительного Курт превратился в замкнутого и вспыльчивого. Поссорился с девушкой, дав ей несколько пощечин. А затем из-за какой-то мелочи затеял драку со своим лучшим другом. Уже эти поступки явно отражали, что что-то идет не так, однако грубость и перепады настроения все сочли явлением спонтанным и не связанным с антидепрессантом. На тот момент было известно: одна из проблем препарата заключается в том, что лечебный эффект развивается не сразу, поэтому очень важно не бросать принимать его на начальном этапе. Никаких данных об агрессивном поведении на фоне терапии прозаком не было.
Меж тем события лишь продолжили накаляться, и на 13-й день Курт намеренно въехал в каменную стену на своем грузовике. Разбитый грузовик изрисовал надписями и знаками, похожими на те, что рисовали члены секты «Семья» Чарльза Мэнсона.
На 17-й день приема прозака без каких-либо причин Курт расстрелял из ружья своего отца.

Следствие растянулось на 18 месяцев. После отмены препарата, осознав всё, что произошло, Курт своей вины не признал. Он любил отца, у него не было никаких мотивов для убийства, а то, что происходило с ним в период терапии, он теперь едва помнил, как и тот роковой день, навсегда оставшийся в его памяти лишь чередой оглушительных выстрелов. У защиты были попытки оправдать Курта или хотя бы смягчить наказание, ссылаясь на то, что именно прием прозака мог послужить причиной такого неадекватного состояния. Однако какие-либо данные о возможной связи антидепрессанта с агрессивным поведением на тот момент отсутствовали.
Под давлением следствия Курт в конце концов признал свою вину. Тогда он уже длительное время принимал два сильных транквилизатора, тем не менее слушание состоялось, и суд вынес приговор — 60 лет строгого режима.
Последним словом Курта станет сожаление о содеянном перед семьей и обращение к покойному отцу: «Я знаю, что ты всё видишь, папа. Я всегда любил тебя и никогда не хотел сделать тебе что-то плохое».

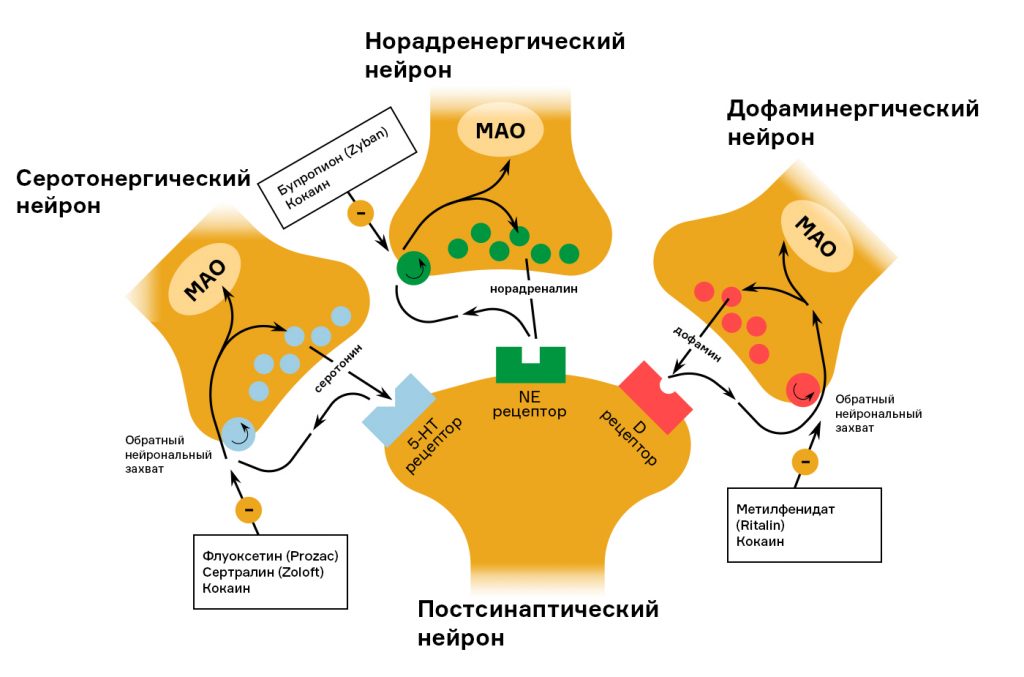
Флуоксетин относится к группе средств, которые ингибируют обратный захват нейромедиатора серотонина (СИОЗС — селективные ингибиторы обратного захвата серотонина). Когда нейромедиатор из отростка одного нейрона попадает в межсинаптическую щель, он какое-то время находится в этой щели, действуя на другой нейрон, а затем с помощью белков-переносчиков захватывается обратно в отросток. Таким образом молекулы нейромедиатора могут многократно использоваться.
Если заблокировать белки-переносчики, которые осуществляют обратный нейрональный захват, медиатор значительно дольше находится в просвете синапса, при последующих выделениях происходит его накопление, и эффект действия увеличивается. По такому принципу работают многие другие психоактивные вещества: антидепрессант сертралин (Zoloft®) ингибирует обратный нейрональный захват серотонина, риталин, использующийся для лечения синдрома дефицита внимания и гиперреактивности у детей, — преимущественно дофамина. А, например, кокаин действует на захват сразу трех нейромедиаторов: норадреналина, дофамина, серотонина.
Попытки совершить самоубийство однократным приемом больших доз СИОЗС-препаратов чреваты развитием серотонинового отравления. Это состояние потенциально смертельно и проявляется повышением температуры до 40 градусов, тошнотой, эйфорией или ажитацией. А вот если при систематическом приеме действие вещества оказывается более выраженным, это влечет за собой самые разные последствия.
Исходя из накопленных данных, в 2004 году FDA (американский орган, регулирующий применение лекарственных препаратов) подтвердило факт, что СИОЗС могут вызывать эпизоды психоза, особенно у подростков и молодых людей.
В инструкции к препаратам этой группы отдельно на черном фоне появилось предупреждение о возможном риске суицидального поведения у подростков. Был поднят вопрос: существует ли подобная связь с агрессивным поведением и неконтролируемой жестокостью. На тот момент уже был известен ряд резонансных дел, связанных с приемом СИОЗС: например 15-летний Кип Кинкл, который принимал прозак и риталин и в один прекрасный день расстрелял родителей, а затем открыл огонь по одноклассникам. Еще один случай — это история Харриса Эрика и Клиболда Дилана, которые устроили массовое убийство в школе «Колумбайн», а затем совершили самоубийство (Харрис принимал СИОЗС-препарат — лювокс).
Осенью 2004 года в редакцию British Medical Journal была передана папка с документами. Документы принадлежали «Эли-Лилли», и в них были изложены исследования, проводившиеся еще в 80-х. Страницы были проштампованы странной печатью “Fentress Confidential”. Выяснилось, что уже на тот момент корпорация обладала данными о том, что флуоксетин может провоцировать агрессивное поведение, однако намеренно скрывала их под предлогом «коммерческой тайны», считая имеющиеся сведения незначительными. Слово “Fentress” оказалось фамилией одной из жертв прозак-спровоцированной стрельбы в конце 80-х. За это сокрытие «Эли-Лилли» не понесла никакой ответственности, однако дело получило резонанс, дав толчок к новым исследованиям. У Курта появилась надежда обжаловать приговор.

Что происходит с лекарственным веществом, когда оно попадает в организм?
События могут складываться по-разному, и результат — развитие лечебного и нежелательных эффектов — зависит от многих факторов. В 1951 году в клиническую практику вошел препарат суксаметоний — миорелаксант, для которого характерно быстрое начало действия (в течение минуты после введения) и кратковременный эффект (не более 10 минут). Он идеально подходит для небольших операций, например интубации трахеи, и широко используется до сих пор. Короткая продолжительность действия суксаметония обусловлена тем, что в крови содержится фермент псевдохолинэстераза, и она за счет реакции гидролиза быстро разрушает значительное количество препарата. В итоге до мышечной ткани доходит приблизительно одна десятая часть вводимой дозы, которая затем так же стремительно гидролизуется и инактивируется.
В большинстве случаев всё работало должным образом, однако у некоторых людей паралич мускулатуры и остановка дыхания вместо ожидаемых 10 минут длились около 2–3 часов, что требовало экстренной реанимации. При обследовании таких пациентов выяснили, что активность фермента псевдохолинэстеразы в их крови значительно снижена. Это вело к повышению концентрации вещества в кровотоке и к его значительно более длительному действию. При обследовании родственников пациентов с атипичной реакцией на суксаметоний было установлено, что у многих из них также снижена активность псевдохолинэстеразы. Так был выявлен наследственный характер реакции. Это открытие стало первым показательным примером того, как наши гены могут определять действие лекарственного вещества. Здесь начинается отправная точка развития фармакогенетики.
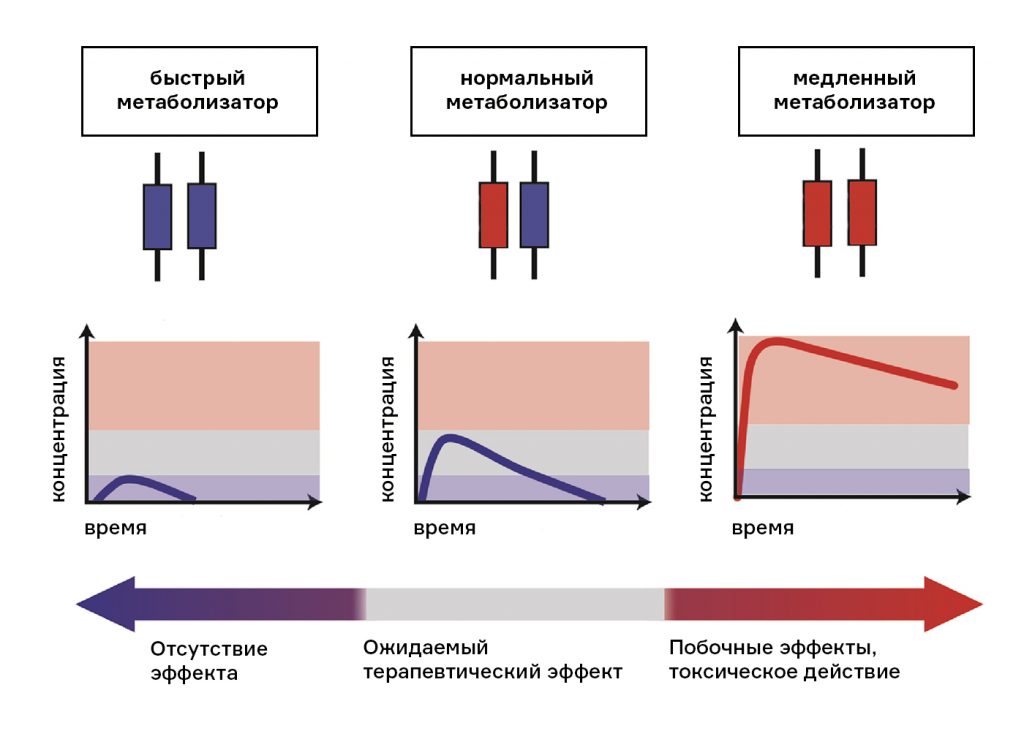
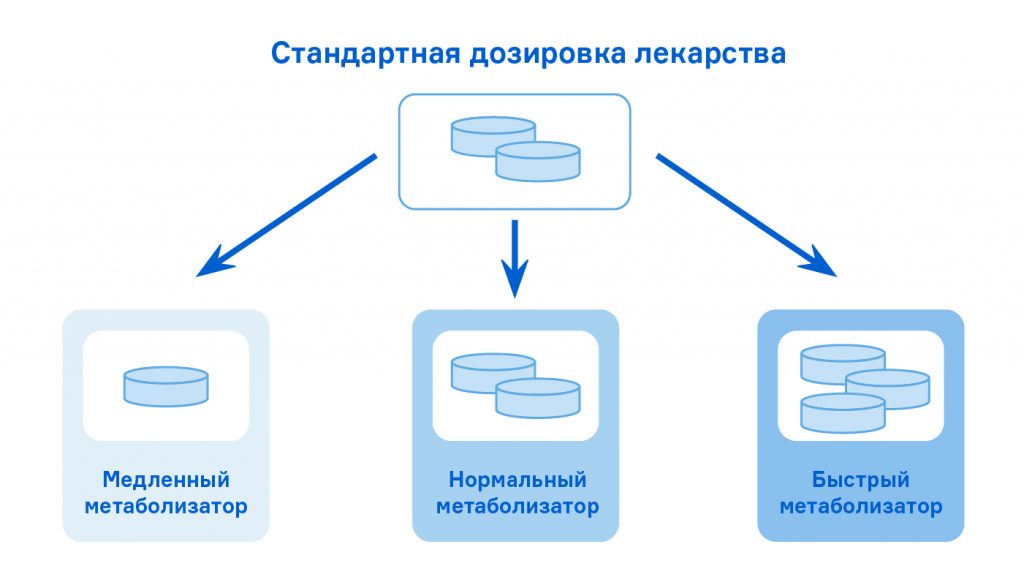
В 1977 году Iddle и Mahgoub обратили внимание на выраженные различия в снижении давления у больных артериальной гипертензией, применявших дебризохин. Одна и та же доза у разных пациентов вызывала либо критическое снижение давления, либо почти не оказывала эффекта. Как и в случае с суксаметонием, было сформулировано предположение, что фермент, участвующий в биотрансформации молекул дебризохина, у разных людей имеет разную активность. Людей, у которых фермент работал медленно, стали называть «медленными метаболизаторами», а тех, у кого активность фермента была высокой, — «быстрыми метаболизаторами». Позднее было показано, что у медленных метаболизаторов дебризохина также замедлен метаболизм ряда лекарственных средств, в том числе большинства препаратов, используемых в психиатрии. Вскоре стало понятно, что за их биотрансформацию в организме отвечает один и тот же фермент — цитохром P450 CYP2D6.
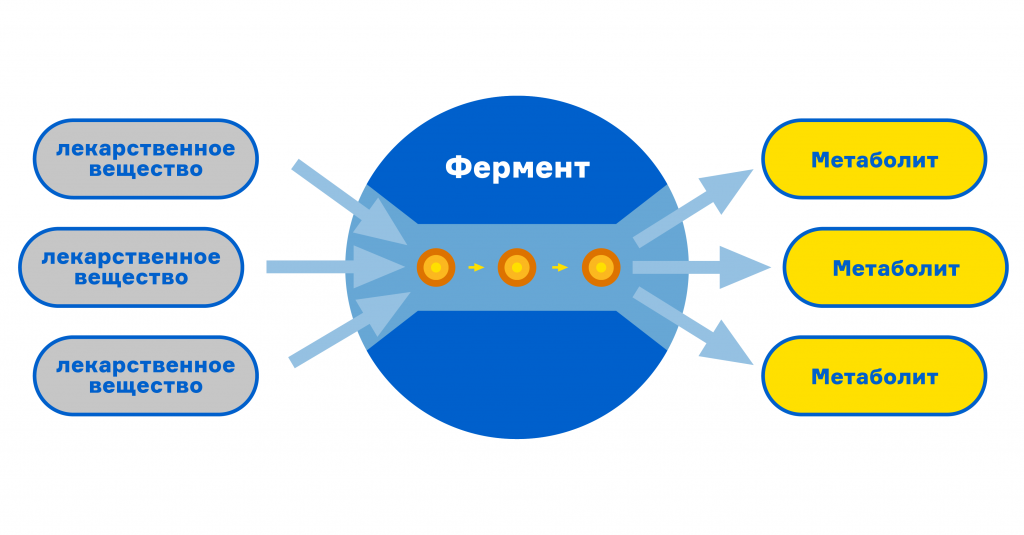
Молекулы лекарств, попадающие в организм, по умолчанию являются для него незнакомыми — ксенобиотиками. В ходе эволюции сформировались разные механизмы, направленные на максимально быстрое выведение всего, что не относится к питательному и строительному.
Самой мощной системой, ответственной за инактивацию и выведение биологически-активных веществ, является система белков-цитохромов. Эти белки находятся в клетках печени и в ходе окислительно-восстановительных реакций трансформируют молекулы неизвестного вещества в форму, на которую удобно присоединить разные гидрофильные радикалы вроде ацетильной или сульфатной групп. При присоединении гидрофильных радикалов активность молекул снижается, повышается их растворимость, и они без труда выводятся, например, через почки.
CYP2D6 — один из ферментов системы цитохромов, ответственный за выведение целого ряда известных лекарственных средств. Флуоксетин также относится к веществам, которые биотрансформируются под его действием. У людей с низкоактивным ферментом CYP2D6 флуоксетин выводится очень медленно, и эффект его в разы увеличивается, а при постоянном приеме значительно возрастает концентрация в крови. В случае с высокоактивной формой всё происходит наоборот — и эффект при средней дозировке может так и не наступить. Обладая двойным набором хромосом, мы можем нести два варианта гена одного и того же белка: один от матери, второй — от отца. Если в геноме человека присутствует и «быстрый», и «медленный» варианты цитохрома CYP2D6, работа фермента усредняется. А если два «быстрых» — человек окажется «ультрабыстрым метаболизатором».
Когда в 2008 году Курту провели генетическое исследование, оказалось, что он является гомозиготой по 4-й аллели CYP2D6: то есть и от матери, и от отца он унаследовал практически неактивные варианты гена. При приеме средней дозировки флуоксетина это в короткий срок привело к значительному повышению концентрации препарата в крови, психозу и неконтролируемой жестокости.
Из-за сложности дела и тонкостей судебного процесса попытки Курта обжаловать приговор до сих пор остаются безрезультатными. Сейчас он работает над книгой, посвященной жертвам неконтролируемой терапии антидепрессантами, не теряет надежды досрочно выйти на свободу и посвятить себя этой проблеме.
Тем не менее многим удается обжаловать свой приговор и получить помилование. Так, одним из первых в 2000 году был Кристофер ДеАнджело осужденный за разбойное ограбление банка. На момент преступления мужчина принимал прозак (дозировка которого в три раза превышала необходимую в случае его расстройства) и транквилизатор ксанакс. В том же году вышла на свободу Шэрон Л. Карри, зарезавшая свою дочь в результате психоза, развившегося на фоне приема пароксетина (средство СИОЗС). А в 2002-м была помилована Джоди Лиза Генри из Аризоны, также принимавшая СИОЗС, в результате чего у нее развился психоз, и она пыталась убить двух своих дочерей.
С помощью генетических тестов сегодня можно досконально точно предсказать, что будет происходить с конкретным веществом в каждом конкретном организме, оценить преимущества лечебного эффекта над нежелательными лекарственными явлениями и исходя из этого подобрать нужный препарат и его дозировку.
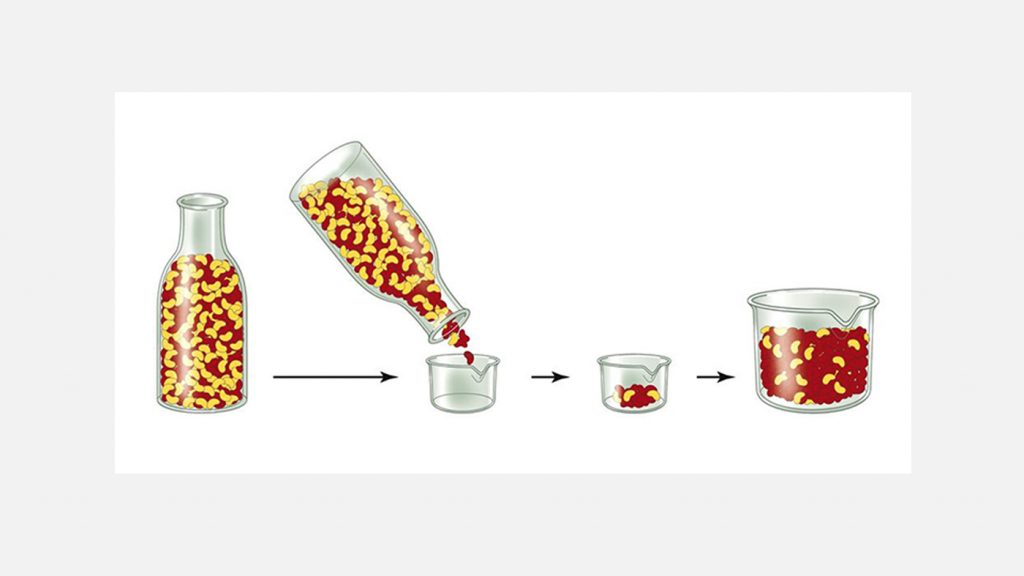
Некоторые такие тесты внедрены в клиническую практику и относительно распространены, однако в большинстве случаев дозы до сих подбираются эмпирически, исходя из клинических рекомендаций. Последний подход имеет место и неплохо работает, потому что в популяции один из вариантов гена — так называемый дикий аллель — может преобладать и встречаться у большинства особей. Он необязательно кодирует какой-то высокопроизводительный или эволюционно выгодный признак, потому что дикие аллели захватывают популяцию способами, не связанными с естественным отбором. Например, когда численность популяции резко уменьшается под воздействием внешних факторов (в случае катаклизмов или кровопролитных войн), устранение большого числа особей будет случайным. С восстановлением численности популяции в ней будут накапливаться гены, характерные для случайно выживших индивидуумов. В результате генетическое разнообразие окажется гораздо меньшим, чем в исходной популяции. Это один из примеров дрейфа генов, который называется эффектом бутылочного горлышка. Наглядно его можно продемонстрировать, высыпая горох из бутылки. В бутылке равномерно распределены желтые и коричневые горошины. Через горлышко высыпается рандомная горстка, в которой, допустим, коричневых больше чем желтых. Если эту горстку посеять и собрать урожай — подавляющее большинство выросших горошин также окажутся коричневыми.
В случае цитохрома CYP2D6 аллель дикого типа среди представителей европеоидной расы кодирует белок с нормальной активностью. Соответственно, рекомендованные дозы лекарства, которое им метаболизируется, будут рассчитаны для потенциального большинства нормальных метаболизаторов (в разных популяциях их число варьирует от 61 до 90 %), а в остальных случаях (медленные и ультрабыстрые метаболизаторы) придется разбираться в процессе лечения — корректировать дозировку либо заменять препарат. Этот подход работает. Однако когда пациент оказывается носителем редкого варианта гена и развитие нежелательных лекарственных явлений вовремя не отслеживается — это, как в случае с бедолагой Куртом, может приводить к самым непредсказуемым последствиям.
В 2004 году фирмой «Рош» для выбора антидепрессантов и антипсихотиков был разработан первый ДНК-чип AmpliChip CYP450, позволяющий определять сразу до 50 вариантов генов CYP2D6 и CYP2C19, среди которых особенно важно отслеживать «медленные» аллели. Он широко использовался, однако на данный момент его вытеснил более расширенный алгоритм GeneSight, который учитывает не только генетические особенности ферментов цитохромов, но также гены белков-мишеней, связываясь с которыми, вещество реализует фармакологическое действие.
Интерпретируя комплекс генетических тестов, программа создает три категории — «Применять без предостережений», «Применять с осторожностью», «Применять с частым мониторингом состояния», — в которые вынесены названия антидепрессантов и антипсихотиков с пояснениями, по какой причине тот или иной препарат находится в соответствующей группе и чего именно стоит опасаться.

GeneSight, как и AmpliChip CYP450, отражает постепенное развитие современной медицины в сторону персонализации, от общего к частному, когда при подходе к пациенту учитываются конкретно его особенности, а не что-то усредненное в популяции. Возникают новые этические проблемы: как далеко зайдут фармакогенетические разработки, будут ли они широко доступны и какова конфиденциальная сторона вопроса? Кажется, совсем рядом будущее генетических паспортов, когда, основываясь на последовательности миллиардов пар нуклеотидов, стратегию лечения, возможные риски и перспективы будет определять искусственный интеллект. Будущее, управляемое большими данными.
