«Заштопайте мне ДНК!»: для коррекции генов прямо в организме хватило укола
Ребенка с генетическим заболеванием впервые в истории лечат методом персонализированной терапии CRISPR. Рассказываем, как редактирование ДНК меняет медицину.
«Десятимесячный Кей Джей Малдун чувствует себя хорошо, хотя о полном излечении говорить рано», — эта фраза в последние дни обошла научные издания мира, хотя еще неделю назад никто не слышал про этого мальчика с тяжелым генетическим заболеванием, нарушившим способность его организма перерабатывать белки.
Все дело в том, что Кей Джей недавно получил три инъекции разработанного специально для него лекарства, редактирующего геном его клеток методом CRISPR прямо внутри организма.
Эта новость пахнет будущим, ведь именно такой должна стать медицина.
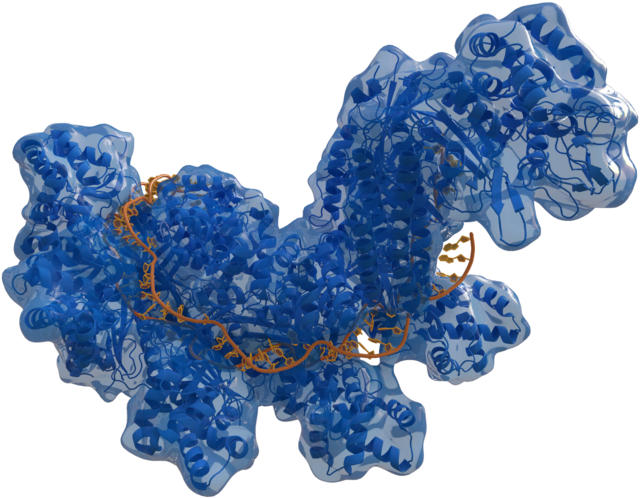
Как кромсают ДНК
Во-первых, медицина ближайшего будущего научится исправлять генетические ошибки. Главным прорывом, в этой области, запустившим настоящую биоинженерную революцию в медицине, стал CRISPR/Cas9 — метод редактирования генома, давший ученым возможность с помощью особых ферментов находить нужный участок ДНК и менять его, вырезая или добавляя строки генетического программного кода. Поначалу было много ошибок, но постепенно их число снизилось почти до нуля. За открытие этого метода француженка Эммануэль Шарпантье и американка Дженнифер Дудна получили в 2020-м году Нобелевскую премию по химии.
В Китае подрастают первые генетически модифицированные CRISPR дети — девочки Нана и Лулу, родившиеся в 2018 году. Эксперимент с редактированием генов человеческим эмбрионам, которым даже не угрожала смертельная опасность, был осужден научной общественностью как слишком рискованный, а биолог Хэ Цзянькуй, отредактировавший им ДНК (он сделал геном девочек неуязвимым для ВИЧ, которым были заражены их родители), был приговорен к трем годам лишения свободы.
Но показательно, что выйдя из тюрьмы, Хэ Цзянкуй сразу вернулся к исследованиям генной терапии врожденных патологий, возглавив созданный в 2023-м в Ухане Институт генетической медицины. Опыты на эмбрионах по-прежнему запрещены в большинстве стран, зато для взрослых придумали этически безобидный трюк: извлекают нужные клетки из тела, редактируют и вводят обратно.
В клинической практике уже применяют редактирование генома с помощью CRISPR (хотя гораздо большая часть таких терапий еще испытывается в лабораториях — ведь метод создан совсем недавно). Прежде всего, это заболевания связанные с поломкой одного гена. Например, десятки людей излечились с помощью CRISPR для серповидноклеточной анемии, — у пациента берут костный мозг, с помощью безвредного вируса встраивают в ДНК клеток нормальный ген, вместо сломанного, а затем отредактированные клетки подсаживают обратно больному.
Самая перспективная сейчас методика лечения рака — «CAR-T терапия» — тоже основана на редактировании ДНК. У пациента берут Т-лимфоциты (клетки иммунной системы, атакующие чужеродные клетки в нашем организме), добавляют в их ДНК ген рецептора, распознающего раковые клетки (то есть «нацеливают» их на нужную мишень) и запускают обратно в организм — расправляться с опухолью. Вместо лекарств-молекул лекарством становятся живые клетки, запрограммированные на выполнение нужных задач. Такие живые лекарства — новый тренд в фармакологии: лимфоциты сейчас программируют для самых разных целей, от доставки лекарств в мозг до борьбы со старением.
В 2024 году произошло очень важное для терапии рака событие — в США впервые одобрили препарат для CAR-Т терапии «твердой» опухоли, хотя терапия CAR-T дебютировала как метод лечения «жидких» опухолей, таких как рак крови, почти 15 лет назад. Лимфоциты генетически модифицировали для поиска и уничтожения В-клеток, другого компонента иммунной системы, — и возвращали их пациенту. Раковые В-клетки лежат в основе некоторых видов лейкемии и лимфом, — а терапия CAR-T способна их уничтожать.
А потом выяснили, что эти В-клетки оказываются слабым звеном и в возникновении аутоиммунных заболеваний — именно они ошибочно производят вредоносные антитела, которые поражают наши суставы, или легкие, да что угодно. В 2024 году было проведено множество клинических испытаний проверки эффективности терапии CAR-T против В-клеток при аутоиммунных заболеваниях — волчанке, склеродермии, рассеянном склерозе. Так редактирование генома открыло новую главу и в лечении аутоиммунных заболеваний.
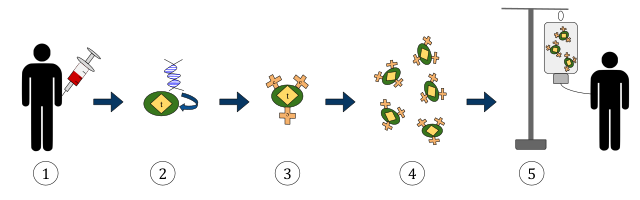
Случай Малдуна
Что же тогда особенного в новости про успешное лечение Кей Джей Малдуна?
У медицины будущего должна быть еще одна очень важная особенность — она станет персонализированной. Сейчас врач назначает лечение исходя из того, что люди устроены более или менее одинаково — вам выписывают то же лекарство, что и другим несчастным с тем же диагнозом. До сих пор так было и с редактированием генов — всем больным исправляли одну и ту же поломку ДНК одним и тем же стандартным методом.
Но изучение генома радикально меняет этот подход — лечить будут не болезнь, а человека как носителя неповторимого набора генов, уникальных программ для организма. Лечение будут назначать, изучив, как работает генетическая программа человека и в чем именно она нуждается. Появятся лекарства, разработанные лишь для одного больного, подобно одежде, сшитой на заказ.
Уже появляются! Собственно в этом и новость — ученые и медики собрали персонализированную генетическую терапию под конкретный случай, провели испытания, получили одобрение и ввели пациенту — и все это заняло не десяток лет, как раньше, а за полгода.
Иначе мальчик просто бы умер. Он унаследовал две мутации, по одной от каждого родителя, в каждой из двух копий гена, отвечающего за фермент печени CPS1, необходимый для выведения аммиака, который образуются, когда организм расщепляет белок. В результате в его крови был высокий уровень аммиака, токсичного соединения, которое особенно опасно для мозга.
Обычное лечение для людей с таким заболеванием — это трансплантация печени. Поначалу Малдуна записали в очередь на трансплантацию, но его черед настанет лишь через несколько месяцев. Между тем, каждый день приносил дополнительный риск повреждения мозга или смерти: лишь половина младенцев с тяжелым дефицитом CPS-1 доживают до трансплантации.
Команде врачей из Университета Пенсильвании удалось очень быстро адаптировать для лечения этого случая разрабатываемую ими технику на основе CRISPR, которая может вносить целевые изменения в последовательности ДНК по одной «букве» (в данном случае надо было заменить сломанную пару букв-оснований на здоровую). Ее испытали на животных, а потом всего за неделю получили у регулирующих органов разрешение на вмешательство в гены. Первую дозу препарата девятимесячный мальчик получил в феврале, потом в марте и апреле. Теперь он может есть белковую пищу без риска для жизни.
Пока рано говорить о том, насколько эффективна терапия, — слишком рискованно делать биопсию печени, чтобы определить, сколько клеток печени было исправлено с помощью аппарата CRISPR. Чтобы оценить эффективность, отслеживают уровень аммиака в крови и некоторые другие показатели, — да и просто то, что мальчику стало намного легче.

А что нам это даст?
Но ведь эта схема лечения была создана специально для Кей Джея, никого другого вылечить с ее помощью не получится... Это только для счастливчиков и богатеев?
Важно, что технология успешно опробована на практике. Постепенно персонализированное лечение будет доступно и другим больным — людей, страдающих редкими и уникальными заболеваниями из-за нарушений в генах — сотни миллионов.
Но речь не только о них. Например, лечении онкологических заболеваний тоже станет персонализированным, причем для него потребуется прочитать и геном опухоли. Терапию подберут под молекулярную картину опухоли, изучат, какие именно изменения в геноме привели к тому, что ткань начала неконтролируемо разрастаться. И осуществят максимально эффективное воздействие на конкретные гены, вместо перебора разных видов химиотерапии.
Когда-то расшифровка первого человеческого генома заняла 13 лет, сегодня это можно сделать за двое суток и в тысячи раз дешевле. Однажды в медицинских кабинетах появятся мини-секвенаторы — пациент плюнет туда, секвенатор пожужжит, проанализирует геном, — и врач выпишет лекарство для ДНК.
Кстати, а почему речь только о болезнях? Есть ведь гены, связанные с глупостью, или агрессивностью, или уродством...
