Век борьбы с ожирением. Почему большинство старых препаратов против лишнего веса попали под запрет и что пришло им на смену
В мире незаметно бушует эпидемия ожирения. Лишний вес встречался у людей еще в древности, но только к началу XXI века появились более-менее эффективные методы борьбы с ним. Прошлое столетие внесло серьезные изменения в понимание причин и механизмов развития ожирения, однако путь к созданию лекарственных препаратов для снижения веса оказался нелегким: многие из них либо не действовали, либо причиняли вред здоровью. Илья Чикунов — о том, как лечили ожирение раньше, и о том, чего добилась наука за последние десятилетия.
18+
Настоящая статья не содержит медицинских рекомендаций и не подчеркивает преимущества какого-либо препарата. Информация о запрещенных к обороту в РФ веществах предоставлена исключительно для предостережения читателей от случайной покупки опасных жиросжигающих средств, их содержащих.
Перед решением о начале приема любых средств, направленных на медикаментозное снижение массы тела, необходимо проконсультироваться с лечащим врачом!
Ожирение: чем его лечили раньше и что разрабатывается сейчас
По оценкам ВОЗ, от ожирения в мире страдает более 650 млн человек. Только в 2017 году было зарегистрировано свыше 4 млн смертей от избыточного веса и ожирения. Это число продолжает расти. По прогнозу ВОЗ, к 2025 году примерно 167 млн человек — взрослых и детей — потеряют здоровье из-за избыточной массы тела или ожирения.
Ожирение определяется как индекс массы тела (ИМТ), превышающий 30 кг/м2, и делится на три класса по ИМТ:
- избыточная масса тела — 25–29,9 кг/м2;
- ожирение, степень I — 30–34,9 кг/м2;
- ожирение, степень II — 35–39,9 кг/м2;
- ожирение, степень III — ≥ 40,0 кг/м2.
Ожирение повышает риск развития различных осложнений, особенно сердечно-сосудистых заболеваний. Оно также увеличивает риск онкологии: до четырех раз для эндометриального рака, в пять раз для карциномы пищевода, в три раза — для аденокарциномы пищеводно-желудочного перехода, в два раза — для рака кардиального отдела желудка, печени и почек, до 1,6 раза — для желчного пузыря и внепеченочных желчных протоков.
В настоящее время снижение массы тела рекомендуется при ИМТ ≥ 30 кг/м2 или ≥ 25 кг/м2 при наличии осложнений. На первом этапе врачи советуют изменение образа жизни, ограничение питания и физическую активность. Низкокалорийная (800–1800 ккал/сут) и очень низкокалорийная (< 800 ккал/сут) диеты вызывают краткосрочное снижение массы тела на 9,7% и 16,1% соответственно за ~12,7 недели. Долгосрочное влияние обеих диет на массу тела сходно, если придерживаться их больше года, — 5–6,3%.
Физическая активность — еще одна рекомендуемая мера для снижения веса. Одинаково эффективны тренировки на выносливость, высокоинтенсивные интервальные тренировки и с сопротивлением. Прием лекарственных препаратов врачи рекомендуют при ИМТ ≥ 30 кг/м2 или ≥ 27 кг/м2 с сопутствующими заболеваниями, связанными с ожирением. Бариатрическая хирургия показана при ИМТ ≥ 40 кг/м2 или пациентам с ИМТ ≥ 35 кг/м2 с сопутствующей патологией.
За последние 100 лет попытки создать препараты для лечения ожирения неоднократно заканчивались неудачей. Первые три — это гормоны щитовидной железы, динитрофенол и амфетамин.
Тиреотропный гормон является первым препаратом, рационально использованным для лечения ожирения. В 1888 году при исследовании одной из форм тяжелого гипотиреоза была установлена связь недостаточности выработки гормонов щитовидной железой и увеличения массы тела. Как только стало ясно, что щитовидная железа может повышать скорость метаболизма, джинна выпустили из бутылки — тиреоидные препараты стали массово применять для лечения ожирения. Однако при длительном их приеме возникало серьезное расстройство нервной системы и работы сердца, усиливались расщепление и расход белка и потеря безжировой массы тела. Противопоказания к применению тиреоидных препаратов были многочисленными. Открытие трийодтиронина в 1952 году перевернуло страницу в использовании тиреоидных гормонов для лечения ожирения. Принимавшие его люди теряли вес, но с распространением препарата стали регистрироваться случаи смерти. Впрочем, споры о применении тиреоидных гормонов для лечения ожирения продолжаются и в XXI веке.
Динитрофенол сначала использовался как взрывчатое вещество во время Первой мировой войны, затем — как средство для снижения веса. Французские рабочие, готовившие этот химикат на заводах по производству боеприпасов, после нескольких месяцев работы теряли вес. На это обратили внимание ученые. Этот промышленный химикат стал популярен среди желающих похудеть, в том числе среди культуристов и людей с расстройствами пищевого поведения, хотя уже почти столетие известно, что он чрезвычайно опасен и имеет тяжелые побочные эффекты. Десятки тысяч человек потеряли зрение, сообщалось о смертельных случаях. Динитрофенол запретили в 1938 году, но в 1981-м он вновь появился в продаже. И сейчас его по-прежнему можно найти в интернете, он популярен у культуристов, которые пытаются сбросить вес.
В 1930-х годах возникли новые методы лечения и стал популярен амфетамин, продававшийся под названием бензедрин, и его производные. Они действовали главным образом за счет подавления аппетита, но имели нежелательные побочные эффекты, такие как риск передозировки, развитие зависимости, психозы, проблемы с сердечно-сосудистой системой и давлением. Сейчас они запрещены к обороту в большинстве стран.
В 1940-х годах появились коктейли для подавления аппетита, известные как «радужные таблетки» (Rainbow Pills), которые активно рекламировались среди американских женщин. Яркоокрашенные капсулы часто содержали амфетамины, диуретики, слабительные средства и гормоны щитовидной железы для максимального снижения веса. Всё это представляло серьезную опасность для здоровья. В 1950–1960-х годах «радужные таблетки», представляющие собой комбинацию амфетамина, дигиталиса и диуретика, привели к ряду смертей. И в 1968 году в США таблетки запретили.
Аминорекс, амфетаминоподобный препарат, разрешили к применению в Германии, Австрии и Швейцарии в 1965 году. Вскоре в 5–20 раз увеличилось число случаев легочной гипертензии, связанной с применением аминорекса, который, по-видимому, и стал их причиной. В Берне до 20% пациентов, принимавших аминорекс и попавших в больницу, умерли, еще до 50% умерли в течение следующих 10 лет. Такая токсичность подтолкнула к скорейшему прекращению продаж всех родственных препаратов.
Фенфлурамин/дексфенфлурамин (в России препарат внесен в Список II перечня наркотических средств) разработан во Франции и поступил на рынок в 1964 году. Его молекула имеет структурное сходство с амфетамином. В 1973 году препарат стали использовать для лечения ожирения. Однако выяснилось, что он вызывает легочную гипертензию и вальвулярную болезнь сердца. В итоге в 1997 году фенфлурамин и дексфенфлурамин были изъяты из продажи во всех странах.
Сибутрамин привлек внимание в 1988 году. В экспериментах за восемь недель наблюдалась удвоенная потеря веса по сравнению с плацебо при применении низкой дозы и почти четырехкратная — при высокой. Оптимистичные результаты были омрачены повышением артериального давления, но препарат разрешили к продаже. Сибутрамин привел к значительному росту числа сердечно-сосудистых заболеваний у 11,4% пациентов, включая несмертельный инфаркт миокарда, остановку сердца и смерть, после чего его сняли с продажи в Европе. Но, несмотря на это, сибутрамин до сих пор можно найти в продуктах, продающихся в интернете. FDA (Управление по контролю качества пищевых продуктов и лекарственных средств) США обнаружило его в большинстве из проверенных препаратов для похудения. Американские специалисты определили, что эта продукция поступает в основном из Китая и представляет опасность для здоровья.
Разработка римонабанта — антагониста каннабиноидных рецепторов — это яркий пример провала с многообещающим началом и печальным финалом. Клиническая программа тестирования римонабанта как препарата для снижения веса дошла до третьей фазы. Участники тестирования потеряли 3,6–8,6 кг, однако при этом возрастала склонность к суициду. Римонабант был одобрен в Европе, но не в США. Спустя чуть более двух лет после одобрения продажу римонабанта в Европе приостановили из-за проблем с психикой и увеличения числа самоубийств у лиц, принимавших препарат. Это привело к прекращению всех исследований римонабанта, а также других антагонистов каннабиноидов.
Выше перечислены лишь наиболее яркие примеры неудачных препаратов, коих было великое множество. Часть разработок не вышла со стадии клинических испытаний, часть была выпущена на рынок, но отозвана из-за опасных побочных эффектов. Далее мы рассмотрим «выжившие» препараты, созданные еще в прошлом веке.
Так, фентермин (в России внесен в Список II перечня наркотических средств) — одно из производных амфетамина, которое одобрено к продаже в США в 1959 году и продается до сих пор.
В отличие от других представителей этой группы, которые постепенно пропали с рынка из-за проблем с токсичностью, на долю фентермина к 2019 году пришлось более 75% препаратов для борьбы с ожирением, используемых в США.
Бупропион впервые синтезирован в 1969 году и запатентован в 1974-м. Это ингибитор обратного захвата норадреналина и дофамина, одобренный в США для лечения депрессии и как средство, помогающее бросить курить. В клинических исследованиях пациенты теряли 6% от исходной массы тела по сравнению с 2,8% в группе плацебо. В целом препарат переносится умеренно из-за распространенности побочных эффектов. Комбинация бупропиона и налтрексона в настоящее время одобрена в США и странах ЕС для лечения осложненного избыточного веса и ожирения. В РФ эфедрон и его производные внесены в Перечень наркотических средств, психотропных веществ и их прекурсоров, то есть бупропион рассматривается как производное наркотика. Известны случаи, когда покупка препаратов на его основе приводила к арестам покупателей.
Орлистат (тетрагидролипстатин) — препарат для борьбы с ожирением, одобренный в ЕС. Показаниями к его применению являются ИМТ ≥ 30 кг/м2 и ИМТ ≥ 28 кг/м2 с факторами риска сердечно-сосудистых заболеваний. Орлистат действует путем блокирования липаз желудка и поджелудочной железы, которые отвечают за расщепление триглицеридов на свободные жирные кислоты и глицерин в желудочно-кишечном тракте. В результате меньшее количество свободных жирных кислот в пищеварительном тракте всасывается в кровь. Снижение всасывания жирных кислот напрямую уменьшает риск развития гипертонии, дислипидемии и способствует снижению веса. В рекомендуемой дозировке орлистат снижает всасывание жиров примерно на 30%. Он выпускается как безрецептурный препарат в дозировке 60 мг и как рецептурный в дозировке 120 мг. При лечении орлистатом может нарушаться всасывание некоторых витаминов, особенно жирорастворимых A, D, E, K. Поэтому обычно вместе с ним рекомендуется прием поливитаминов. Между приемом орлистата и витаминов должен быть интервал не менее двух часов. Орлистат благоприятно влияет на уровень глюкозы и инсулина, то есть вызывает антидиабетогенное действие у людей с повышенной вероятностью развития диабета. Наиболее распространенным побочным эффектом является послабление стула (28,5%) из-за меньшего переваривания и всасывания простых жиров — триглицеридов. Реже отмечались боли в животе. Сообщалось о нескольких случаях нарушения функции печени вплоть до печеночной недостаточности, требующей трансплантации, и об остром повреждении почек у пациентов с уже больными почками.
Лираглутид показан для лечения ожирения при ИМТ ≥ 30 кг/м2 и ИМТ ≥ 27 кг/м2 при наличии хотя бы одного сопутствующего заболевания. Препарат вводится путем подкожной инъекции. Период полувыведения составляет в среднем 13 часов, поэтому его можно вводить один раз в день, что достаточно удобно. Лираглутид является аналогом GLP-1. GLP-1 — эндогенный гормон инкретин, вырабатываемый клетками тонкой кишки. Рецепторы GLP-1 расположены в различных тканях: центральной и периферической нервной системе, пищеварительном тракте, поджелудочной железе, сердце и кровеносных сосудах. Аналоги GLP-1 вызывают задержку опорожнения желудка, что приводит к длительному ощущению сытости. Исследование, в котором участвовали люди с ИМТ ≥ 27 кг/м2 и диабетом 2-го типа, продемонстрировало эффективность лираглутида. Через 56 недель 51,8% (против 24% в группе плацебо) испытуемых потеряли ≥ 5% массы тела, а 33,1% (против 10,6%) — ≥ 10% массы тела. У принимавших лираглутид также наблюдалось значительное снижение уровня гликированного гемоглобина HbA1c (отражает содержание глюкозы в крови). Наиболее частыми побочными эффектами были желудочно-кишечные симптомы: тошнота у 40,2% и диарея у 20,4%.
Семаглутид — еще один аналог GLP-1, который в начале 2022 года одобрили в ЕС в качестве препарата для лечения ожирения у пациентов с ИМТ 30 кг/м2 и более, а также у пациентов с ИМТ не менее 27 кг/м2 с сопутствующими заболеваниями. Как и лираглутид, семаглутид является эффективным и относительно безопасным препаратом, существенно облегчающим снижение веса. По семаглутиду проведены многочисленные исследования. В исследовании, результаты которого опубликованы в 2022 году в журнале Nature, эффективность семаглутида сравнивалась с плацебо в течение 104 недель на фоне диеты с дефицитом калорий и физической активностью. Семаглутид достоверно снижал массу тела и другие факторы риска, связанные с весом. Среднее изменение массы в группе участников, принимавших семаглутид, составило 15,2% против 2,6% в группе плацебо. Семаглутид также продемонстрировал более значительное уменьшение окружности талии (—14,4 см) по сравнению с плацебо (—5,2 см). Семаглутид благоприятно влияет на артериальное давление, уровень глюкозы в крови, С-реактивный белок, HbA1c, липидный профиль крови и инсулин. Неблагоприятные эффекты при применении семаглутида совпадают с другими аналогами GLP-1: они проявляются в виде легких или умеренных преходящих желудочно-кишечных симптомов. Постмаркетинговый анализ выявил у 1% потребителей проблемы со стороны гепатобилиарной системы: холецистит, желчнокаменная болезнь, требующая удаления желчного пузыря.
Ингибиторы SGLT2 (SGLT2i — флозины, глифлозины) способствуют выделению глюкозы с мочой за счет подавления обратного захвата глюкозы в проксимальных канальцах нефрона. Для лечения сахарного диабета 2-го типа получили одобрение дапаглифлозин, эмпаглифлозин, эртуглифлозин, канаглифлозин. Флозины в определенной степени способствуют снижению массы тела, но этот эффект трудно поддерживать из-за компенсаторных механизмов, таких как вторичное увеличение потребления калорий, способствующее почечной потере глюкозы. Упоминавшиеся выше аналоги GLP-1 повышают сытость и снижают тягу к высококалорийной пище, поэтому в некоторой степени потенцируют снижение веса, стимулируемое SGLT2i, оказывая при этом собственное благоприятное воздействие. Исследования с участием пациентов с избыточной массой тела и ожирением без сопутствующего диабета показали устойчивую среднюю потерю веса (4,5 кг за 24 недели по сравнению с плацебо, 5,7 кг за 52 недели) с преимущественной потерей жировой ткани без изменения массы тела. Результаты говорят о хорошей переносимости комбинации. Наиболее частые побочные эффекты — тошнота и раздражение в месте инъекции.
Тирзепатид (мунджаро) разрешен к применению в ЕС с сентября 2022 года для пациентов с сахарным диабетом 2-го типа как дополнительное вмешательство наряду с изменением питания и физической активностью.
Лечение тирзепатидом может быть как монотерапией, так и комбинированной терапией с другими противодиабетическими препаратами. Препарат назначается в виде подкожных инъекций один раз в неделю, что очень комфортно для пациентов.
Биохимически тирзепатид представляет собой синтетический пептид, который проявляет сродство к рецепторам глюкозозависимого инсулинотропного пептида (GIP) и GLP-1. Поэтому тирзепатид можно назвать аналогом GIP и GLP-1. Связываясь с этими рецепторами, он стимулирует выработку и высвобождение инсулина и снижает секрецию глюкагона. Это приводит к эффективному снижению уровня сахара. Крупное международное клиническое исследование третьей фазы, результаты которого были опубликованы в 2022 году, продолжалось 72 недели, его участники получали плацебо или инъекции тирзепатида один раз в неделю и сбалансированную здоровую диету с дефицитом калорий, а также выполняли физические упражнения по 150 минут в неделю. В конце исследования в группе, получавшей лечение, среднее изменение массы тела составило 15~20,9%, в контрольной группе — 3,1%. Более того, 95,3% участников, которые получали тирзепатид и у которых был диагностирован преддиабет, достигли нормогликемии, в то время как в группе плацебо — только 61,9%. Наиболее распространенными побочными эффектами были тошнота, диарея и запор. Легкие или умеренные, они носили преходящий характер. Судя по данным, профиль безопасности тирзепатида соответствует другим методам лечения на основе инкретинов. Тирзепатид продемонстрировал более высокую эффективность в отношении снижения массы тела по сравнению с другими аноректическими препаратами. Положительное влияние на многочисленные факторы риска для здоровья, хороший профиль безопасности и удобство применения (раз в неделю) могут сделать тирзепатид перспективным методом лечения ожирения в ближайшем будущем.
Около 5% тяжелых форм раннего ожирения обусловлены моногенными причинами, причем их частота возрастает в популяциях, где распространены близкородственные браки. Моногенное ожирение — это следствие мутации в гене. В таких случаях образ жизни и даже бариатрическая хирургия редко приводят к существенной потере веса. Но появление новых целевых препаратов меняет подход к лечению моногенного ожирения.
Лептин, открытый в 1994 году, является гормоном жировой ткани и действует в гипоталамусе, снижая потребление пищи и увеличивая энергозатраты. Первым прорывом стало замещение лептина у людей с его врожденным дефицитом, что позволило нормализовать вес и аппетит, восстановить эндокринную и иммунную функции. Применение рекомбинантного аналога человеческого лептина — метрелептина, одобренного FDA в 2014 году, нацелено на врожденный дефицит лептина и липодистрофический диабет.
Разработка сетмеланотида, пептидного агониста MC4R (одобрен FDA США в ноябре 2020 года и в ЕС в 2021-м), значительно изменила подход к лечению пациентов с генетическими вариантами ожирения. Сетмеланотид — единственный препарат, одобренный в США, Великобритании и ЕС для лечения пациентов с редкими заболеваниями. Наиболее частым побочным эффектом является усиление пигментации (вследствие хронической стимуляции меланоцитов), также отмечаются реакции в месте инъекции, тошнота, рвота, нарушения сексуального возбуждения, реже — депрессия и суицидальные мысли. О негативном влиянии на артериальное давление или частоту сердечных сокращений не сообщалось.

Ожирение и хирургия
Эндоскопическая бариатрическая терапия и пероральные гидрогели разработаны для лечения ожирения у людей, которым не подходит бариатрическая операция. Пероральная гидрогелевая терапия одобрена FDA США в 2019 году для взрослых с ИМТ 25 кг/м². Этот метод включает прием капсул, содержащих гидрогелевую матрицу, которая поглощает воду в желудке и образует гелевые кусочки. Они заполняют желудок и создают чувство сытости. Гидрогель расщепляется в толстом кишечнике и выводится с фекалиями. Согласно опубликованным данным, через 24 недели средняя потеря веса составила 6,4%. Наиболее распространенными побочными эффектами были легкие желудочно-кишечные симптомы (например, дискомфорт в животе, метеоризм и диарея).
Лишь немногие эндоскопические методы лечения показали длительную клиническую эффективность, а некоторые (например, зондовая гастростомия) перестали применяться. Современные эндоскопические бариатрические методы лечения включают внутрижелудочные баллоны и эндоскопическую гастропластику.
Внутрижелудочные баллоны снижают потребление пищи за счет ограничения емкости желудка и замедления его опорожнения. Обычно они заполняются жидкостью или воздухом и удаляются через 6–12 месяцев. Метаанализ показал умеренную среднюю потерю веса в 3–6 кг. В недавнем исследовании регулируемых внутрижелудочных баллонов установлено, что общая потеря массы тела через 32 недели составила 15%. Осложнения встречаются нечасто и включают обструкцию выходного отдела желудка, язву желудка и его перфорацию.
Эндоскопическая гастропластика (пликация) уменьшает вместимость желудка с помощью наложения швов на большую кривизну желудка. В единственном рандомизированном контролируемом исследовании эндоскопической гастропластики сообщалось о среднем снижении общей массы тела на 13,6% через 52 недели. У ~1% пациентов развиваются осложнения: перигастральные скопления, сильное кровотечение и тромбоз глубоких вен. Для такого вида терапии пока еще не накоплены высококачественные данные исследований с длительным наблюдением.
Бариатрическая хирургия показана пациентам с ИМТ выше 35 кг/м², особенно когда медикаментозное лечение не эффективно. Чаще всего проводятся лапароскопическая рукавная гастрэктомия и желудочное шунтирование Roux-en-Y, эффективность которых подтверждена надежными данными о долгосрочных результатах и безопасности.
Третья по распространенности процедура — желудочное шунтирование с одним анастомозом. Она особенно распространена в странах Ближнего Востока и в некоторых других. Данные о пользе, вреде, критериях отбора и долгосрочных результатах немногочисленны, и конкурентоспособность этих методов среди более распространенных процедур еще предстоит определить.
Регулируемое желудочное бандажирование (наложение бандажа на верхний отдел желудка и временное уменьшение его объема) составляет лишь 0,9% всех бариатрических операций в мире, при этом долгосрочные результаты снижения веса и гликемии менее впечатляющие, а частота повторных операций выше по сравнению с рукавной гастрэктомией и желудочным шунтированием Roux-en-Y. В краткосрочной перспективе потеря веса при рукавной гастрэктомии и желудочном шунтировании Roux-en-Y одинакова (примерно 30% общей потери массы тела через 12 месяцев).
Благодаря совершенствованию ухода за пациентами и лапароскопическому методу частота послеоперационных осложнений за последние 20 лет снизилась: смертность в течение 30 дней после операции составляет в среднем от 0,03% до 0,20%, а общий риск серьезных осложнений — около 4%. К осложнениям, характерным для обеих операций, относятся желчнокаменная болезнь и недостаточность питания.
Медиков беспокоит, что после рукавной гастрэктомии у 30–45% пациентов возникает или обостряется гастроэзофагеальная рефлюксная болезнь, в том числе появляется пищевод Барретта, считающийся предраковым состоянием. Также значительно возрастает частота пищевых осложнений и желчного рефлюкса. С другой стороны, по сравнению с отсутствием хирургического вмешательства бариатрические операции ассоциируются со снижением общей заболеваемости раком, связанной с ожирением, и смертности от него.
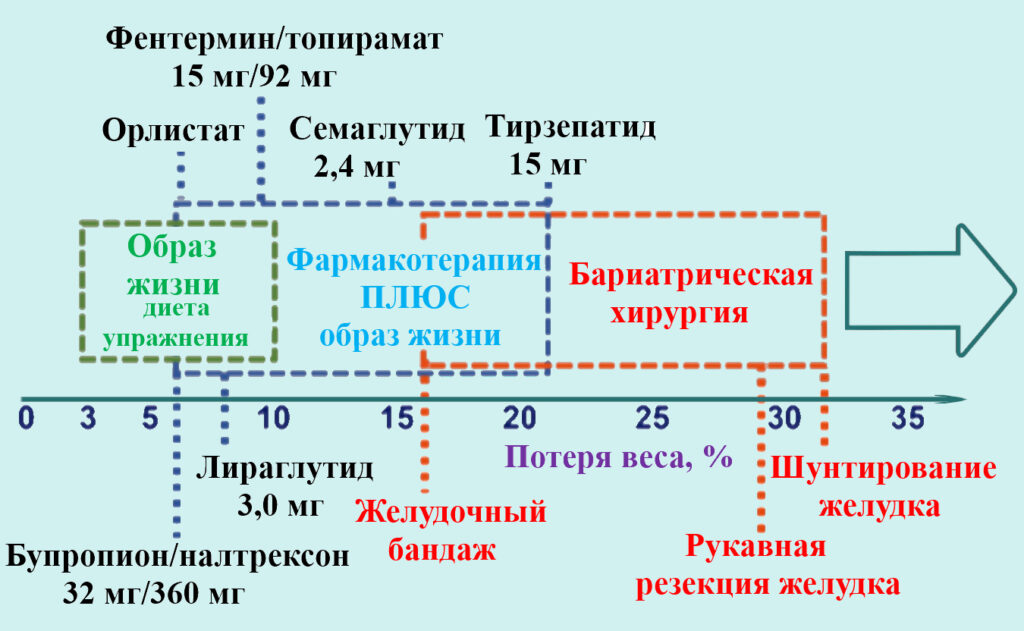
Относительная эффективность основных подходов к снижению избыточной массы тела и ожирения показана на иллюстрации.
Софт на страже веса
Не только фармакология и хирургия помогают избавиться от лишнего веса. С 2000-х годов активно разрабатывается и распространяется программное обеспечение, помогающее худеть. Например, существует ряд бесплатных онлайн-приложений для помощи в процессе похудения. А использование мобильных технологий в деле управления весом прошло путь от пересылки коротких сообщений (SMS) до сервиса мультимедийных сообщений (MMS) и различных продвинутых приложений. Например, Well-D — мобильное приложение для самоконтроля рациона питания; Oviva — для дистанционного получения информации от диетолога. Опрос врачей, занимающихся лечением диабета, показал, что 53% из них рекомендуют пациентам мобильные приложения, наиболее часто — MyFitnessPal (59%), CalorieKing (49,5%) и Fitbit (43%).
Весьма эффективен комбинированный подход. Американские специалисты в исследовании с участием 251,7 тысячи человек оценили, смогут ли пациенты, которые придерживаются программы снижения веса, основанной на мобильном приложении, беспроводных весах и диетической программе, но не получают очного лечения, достичь клинически значимого снижения веса. Через 120 дней 62,7% участников потеряли не менее 5% от исходного веса, причем у мужчин эта потеря была больше, чем у женщин (6,5 против 5,2 кг). Эти результаты показывают перспективность внедрения новых технологий для контроля веса.
В настоящее время рассматриваются возможности искусственного интеллекта в повышении эффективности снижения веса у взрослых. В борьбе с ожирением есть три области применения ИИ: компьютерное восприятие, предиктивная аналитика и аналитика в реальном времени с персонализированными микровмешательствами. Компьютерное восприятие направлено на распознавание продуктов питания, пищевого поведения, физической активности и на оценку энергетического баланса. Предиктивная аналитика — на прогнозирование потери веса, нарушений режима питания и эмоционального питания. Исследования по последней теме посвящены оценке вмешательств в управление весом с помощью ИИ, который мгновенно собирал поведенческие данные, оптимизировал модели прогнозирования поведенческих нарушений и повышал поведенческий самоконтроль с помощью адаптивных и персонализированных «стимуляций». В шести исследованиях сообщалось о среднем снижении веса на 2,4–4,7%. Использование искусственного интеллекта для снижения веса пока недостаточно разработано, но выглядит весьма перспективно.

Эффективность программ по снижению веса, самолечение и запрещенные вещества
Не все люди готовы идти к врачам, чтобы похудеть. Многие обращаются за помощью в коммерческие структуры. Однако купить услугу и получить результат — совершенно разные вещи. Исследователи из Австралии собрали данные о снижении веса у взрослых людей с избыточной массой тела, которые используют коммерческие программы по изменению питания, подсчету калорий или специальному приготовлению пищи. Метаанализ показал неутешительные результаты: 37–57% людей, начавших такие программы, потеряли менее 5% от первоначальной массы тела. В каждом втором (49%) исследовании отсев составил ≥ 30%. Авторы пришли к выводу, что коммерческие программы снижения веса часто не приводят к клинически значимым результатам при высоком уровне отсева. Это говорит о том, что многие потребители считают неприемлемыми те изменения в питании, которых требуют эти программы.
Разочарование может толкать к необдуманным решениям, например к экспериментам с малоизвестными БАДами или импортными препаратами сомнительного производства. Эффективность и безопасность их ингредиентов, как правило, не соответствует ожиданиям потребителей.
Некоторые производители добавляют в БАДы для похудения неодобренные или запрещенные ингредиенты для повышения их мощности.
В итоге многие из этих продуктов могут представлять опасность для здоровья потребителей, а в некоторых случаях вызывать проблемы с законом вплоть до лишения свободы. Исследования показали, что в странах ЕС с 1988 по 2019 год 63,3% пищевых добавок для снижения веса содержали неодобренные синтетические ингредиенты. Основным фальсификатом (35,4%) был тот самый 2,4-динитрофенол, о котором говорилось выше, а вторым по частоте — сибутрамин (21,6%). Эти препараты имеют серьезные побочные эффекты.
Другими наиболее популярными ингредиентами являются хитозан, глюкоманнан, капсаицин, карнитин, токсичная конъюгированная линолевая кислота и некоторые растения. Полисахарид хитозан может частично нарушать всасывание жирорастворимых витаминов A, D, E и K. Капсаицин в приемлемых дозах безопасен, хотя может вызывать неприятные ощущения со стороны желудочно-кишечного тракта, потливость, повышение температуры и насморк, а также взаимодействовать с антигипертензивными препаратами. Распространенные растительные компоненты БАДов являются потенциальными аллергенами или токсичны сами по себе. Действенность же перечисленных «жиросжигателей» подтверждена недостаточно.
Успешное лечение ожирения позволяет избежать или, по крайней мере, снизить риск развития и тяжесть вторичных осложнений. Однако количество одобренных лекарственных средств для снижения массы тела относительно невелико, а их эффективность ограничена. Поэтому значительная часть БАДов для снижения веса фальсифицируется, чтобы удовлетворить ожидания пациентов за счет их же здоровья.
Нелекарственные вмешательства — изменение образа жизни, диета и физическая активность — по-прежнему остаются методами первого выбора для снижения массы тела. В случае их неудачи врачи могут назначить фармакотерапию или хирургические вмешательства. Сейчас разрабатывается и испытывается множество новых перспективных препаратов, в частности на основе пептидов, которые могут найти применение в лечении ожирения, что вызывает обоснованный оптимизм как у медиков, так и у пациентов.
