ДНК- и РНК-вакцины: как работают новейшие технологии вакцинации
ДНК- и РНК-вакцины — инновационные биопрепараты, которые могут повысить эффективность профилактики инфекций, лечения онкологии и других тяжелых болезней. Вакцины на основе нуклеиновых кислот появились еще в 1990-х годах, но до вспышки COVID-19 не были доступны на фармацевтическом рынке. Пандемия коронавируса стала мощным стимулом для ускорения их разработки и лицензирования. Рассказываем о том, как работают вакцины нового поколения, в чем их преимущества и какие надежды возлагает на них медицина.
Принцип работы вакцин с нуклеиновыми кислотами
Новый принцип иммунизации заключается в том, что в организм вводится не сам антиген (например, белок вируса), а ДНК или мРНК, кодирующая этот антиген. После проникновения в клетки они вызывают синтез закодированных в них белков. С помощью методов генной инженерии получить молекулы ДНК и РНК очень просто, что позволяет быстро производить большой объем вакцины. Кроме того, ДНК- и РНК-вакцины отличаются простотой разработки и легко адаптируются к новым вариантам вируса.
Все эти характеристики делают вакцины с нуклеиновыми кислотами перспективными профилактическими технологиями в условиях внезапной пандемии.
ДНК-вакцины состоят из плазмид, кодирующих нужные антигены — белки возбудителей инфекций либо раковых клеток. Плазмиды проникают в ядра клеток, где они экспрессируют антигены, превращая хозяйские клетки в фабрику по производству вакцины. Экспрессия антигенов вызывает защитный иммунный ответ, обладающий профилактическим и лечебным эффектом.
Экспрессия генов — сложный процесс, в ходе которого наследственная информация, хранящаяся в ДНК, преобразуется в функциональный продукт. Этот процесс состоит из пяти этапов:
- Транскрипция. На основе ДНК синтезируется крупная молекула про-мРНК, содержащая информацию об аминокислотной последовательности.
- Процессинг. Про-мРНК уменьшается в размерах и превращается в «зрелую» мРНК , с которой проще считывать генетическую информацию.
- Трансляция. На матрице мРНК синтезируется полипептид — химическое вещество, состоящее из длинной цепи аминокислот. На полипептид переносится генетическая информация.
- Модификация. Полипептид трансформируется в белок с определенными свойствами.
- Экспрессия. Белок вызывает изменения в работе организма и защитные иммунные реакции.
Самые простые способы введения плазмидных вакцин в организм — внутримышечные и подкожные инъекции, однако они требуют большого количества ДНК и малоэффективны, так как сначала вакцина проникает в межклеточное пространство и только потом попадает в клетки.
Разработаны и более эффективные методики:
- Электропорация. ДНК-вакцина вводится с помощью прибора, состоящего из шприца и игл-электродов. Под действием электрического поля в коже образуются поры, что облегчает проникновение вакцины в клеточные ядра.
- Биобаллистика. Ткани организма «обстреливаются» микрогранулами тяжелых металлов, покрытыми молекулами ДНК. Пусковым механизмом выступает генная пушка, напоминающая стрелковое оружие. За счет создаваемого пушкой ускорения микрогранулы легко преодолевают клеточные мембраны и доставляют ДНК в ядра клеток. Первое биобаллистическое оружие было создано в 1980-х годах для воздействия на клетки растений. Оно походило на электрический гвоздезабиватель, для переноса ДНК использовались вольфрамовые шарики. Позже его доработали, а вместо вольфрамовых микрогранул стали использовать серебряные и золотые, менее токсичные для клеток.
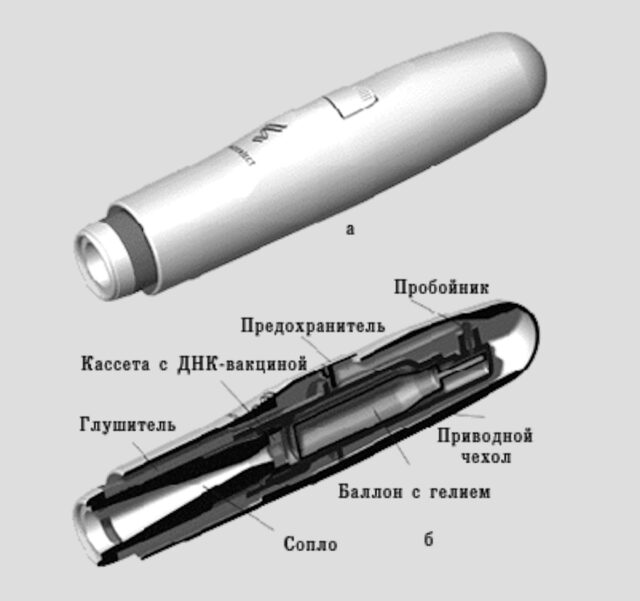
РНК-вакцина содержит мРНК, кодирующую определенный антиген и упакованную в вектор, который может быть представлен наночастицами, полимерными носителями или протамином. РНК-вакцина отличается от ДНК-вакцины тем, что для работы ей не нужно проникать в ядра клеток. Она начинает работать уже в цитоплазме, поэтому добиться с помощью нее сильных иммунных реакций легче. Она показывает эффективность даже при стандартных внутримышечных инъекциях.
Профилактические ДНК- и РНК-вакцины
История ДНК-вакцинации началась в 1992 году: опыт на мышах показал, что инъекция определенной плазмиды способна активизировать гуморальный иммунитет. Через год вышла публикация о выработке клеточного иммунитета у мышей после введения им молекул мРНК, кодирующих нуклеопротеины вируса гриппа С.
С тех пор было проведено много доклинических и клинических испытаний, доказавших, что вакцины с нуклеиновыми кислотами могут стимулировать гуморальные и клеточные иммунные реакции.
Первые опосредованы антителами, вторые — иммунокомпетентными клетками, в том числе Т-лимфоцитами. Клеточный и гуморальный иммунитет действует сообща, дополняя друг друга.
Одно из ключевых направлений клинических испытаний ДНК- и РНК-вакцин — разработка профилактических препаратов против разных патогенов. Например, к таким препаратам относятся РНК-вакцины против гриппа, бешенства. Первая показывает эффективность 78–87%. вторая — 100%.
Активно продвигаются клинические испытания РНК-вакцины против цитомегаловирусной инфекции (ЦМВИ) американской компании Moderna. Вторая фаза клинического испытания продемонстрировала иммуногенность и хорошую переносимость препарата. В 2023 году ведется набор участников третьей фазы исследования.
Примерно 1% беременных заражаются первичной ЦМВИ, которая в половине случаев передается плоду. Инфицирование плода цитомегаловирусом — провокатор развития патологий центральной нервной системы, сердца, прогрессирующей желтухи, пневмонии. Послеродовые осложнения врожденной ЦМВИ — нарушение слуха, слепота, задержка умственного и психомоторного развития.
Во время эпидемии COVID-19 возникла необходимость в быстрой разработке и масштабном производстве эффективных вакцин. Было создано несколько разновидностей, некоторые получили одобрение ВОЗ на экстренное применение. Среди одобренных были инактивированные вакцины, также переносимые аденовирусом и на основе нуклеиновых кислот.
Основными профилактическими препаратами в условиях эпидемии служат инактивированные вакцины, обладающие множеством достоинств. Но, в отличие от ДНК- и РНК-вакцин, они активируют только гуморальный иммунитет и никак не влияют на клеточный. Кроме того, вакцины с нуклеиновыми кислотами создаются быстрее.
ДНК- и РНК-вакцины против SARS-CoV-2 основаны на генетической последовательности шиповидного белка S, придающего вирусу сходство с короной. Именно S-белок ответственен за проникновение коронавируса в клетки, то есть заражение.
Всего было разработано восемь вакцин с нуклеиновыми кислотами против коронавируса, в том числе:
- Американская плазмидная вакцина INO-4800, которая успешно преодолела две фазы испытаний на людях и сейчас проходит третью.
- Индийская ДНК-вакцина ZyCoV-D, одобренная для массового применения.
- Две РНК-вакцины (BNT162b2 и мРНК 1273), получившие разрешение ВОЗ на экстренное применение зимой 2021 года.
После внедрения вакцин в клиническую практику были оценены их эффективность и безопасность. Самые низкие результаты продемонстрировала индийская: эффективность трех доз ZyCoV-D составила 66,6% против симптоматического коронавируса.
Гораздо более обнадеживающие результаты продемонстрировали РНК-вакцины.
Эффективность двух доз BNT162b2 составила 95,0%, а мРНК-1273 — 94,1%. Последняя надежно защищала от тяжелой формы COVID-19. Все одобренные вакцины стимулировали гуморальный и клеточный иммунитет.
Вспышка коронавируса показала, что вакцины на основе нуклеиновых кислот незаменимы в борьбе с внезапной пандемией. Однако разработка этих препаратов находится на начальном этапе, поэтому нужны дальнейшие исследования. Один из вопросов, который волнует исследователей, — безопасность ДНК-вакцин. Существует предположение, что вирусная ДНК способна встраиваться в геном хозяина.
Лечебный потенциал ДНК- и РНК-вакцин
Одна из причин хронических инфекций и онкозаболеваний — неспособность иммунитета противостоять вирусным и опухолевым антигенам. Взаимосвязь между ослабленным иммунитетом и онкологией подтверждается частым возникновением рака у людей с иммунодефицитными состояниями, включая ВИЧ. Адекватная иммунотерапия способна подавлять опасные хронические инфекции и обращать вспять онкологию.
Простота и высокая скорость производства вакцин с нуклеиновыми кислотами позволяют создавать препараты для персонализированного лечения.
Учеными определены многие антигены, способные вызывать иммунный ответ при онкологии и хронических инфекциях. Например, в вакцины против онкозаболеваний, вызываемых ВПЧ, включаются белки E6 и E7, способствующие трансформации нормальных клеток в злокачественные. В вакцины против опухолей неинфекционного происхождения добавляются специфические белки, вырабатываемые раковыми клетками.

Однако эпитопы (элементы макромолекул) антигенов могут варьировать не только от одного вида опухоли к другому, но и отличаться у отдельных пациентов. С этим связана потребность в персонализированных противораковых препаратах. Самый быстрый способ их создания — вакцины на основе нуклеиновых кислот.
Первые экспериментальные персонализированные ДНК-вакцины были разработаны в 1990-х годах для лечения В-клеточных лимфом. Они создавались в ультракороткие сроки — 1–4 недели. Для разработки противораковых препаратов с помощью других технологий ученым требовалось 3–4 месяца.
Терапевтические вакцины для лечения онкологии и хронических инфекций должны вызывать более сильный иммунный ответ, чем профилактические, так как при этих заболеваниях возникает иммунная дисфункция. Например, при хроническом гепатите В наблюдается истощение и апоптоз Т-клеток из-за постоянного присутствия в организме вирусных антигенов.
Способность вакцин с нуклеиновыми кислотами стимулировать иммунитет обусловлена не только экспрессией закодированных антигенов. И ДНК, и РНК сами по себе являются иммуностимуляторами. Нуклеиновые кислоты активизируют врожденные иммунные реакции, которые, в свою очередь, усиливают специфический иммунный ответ против антигена.
Среди клинических испытаний терапевтических ДНК- и РНК-вакцин есть как успешные, так и провальные. Последние связаны с разработкой вакцин для лечения таких хронических инфекций, как ВИЧ, гепатит В и С. Пока создать эффективные препараты ученым не удается, что может быть связано с неверным выбором целевого антигена.
Гораздо более позитивно выглядят результаты клинических испытаний противораковых ДНК- и РНК-вакцин.
Вакцина VGX-3100 показала высокую эффективность в лечении цервикальной интраэпителиальной неоплазии, которая часто предшествует раку шейки матки. При этом заболевании часть эпителия замещается атипичными клетками. Ожидается, что результаты исследования VGX-3100 будут опубликованы в третьем квартале 2023 года.
Ведется разработка ДНК-вакцин против рака молочной железы — одного из самых распространенных онкологических заболеваний у женщин. Во время первой фазы клинических испытаний ДНК-вакцина с маммаглобином-A (Mam-A) показала высокий уровень безопасности. Mam-A — белок, который в 80% случаев экспрессируется клетками опухоли молочной железы. Пациенты показывали высокую выживаемость без прогрессирования рака по сравнению с контрольной группой.
Обнадеживающие результаты демонстрируют ДНК-вакцины против рака простаты, поджелудочной железы, лейкоза. Будущее противораковых МРК-вакцин тоже выглядит многообещающе. И хотя многие из них находятся на ранней стадии исследований, эта область быстро развивается. Один из наиболее перспективных проектов — разработка вакцины для лечения меланомы.
