Лечение слепоты. Как оптогенетика возвращает зрение
Оптогенетика — инновационная технология контроля клеток мозга с помощью света. Эта методика позволяет с высокой точностью воздействовать на разные типы нейронов, что открывает новые возможности для лечения тяжелых болезней, в том числе наследственных дегенеративных заболеваний сетчатки. Рассказываем, как работает оптогенетика и каких успехов она добилась в офтальмологии.
Родопсины — регулировщики нейронов
В 1979 году нобелевский лауреат Фрэнсис Крик сформулировал ключевую проблему нейробиологии, которая не давала покоя ученым: как контролировать один тип нейронов, не воздействуя на другие? Он считал, что электростимуляция мозга — слишком грубая технология, так как она воздействует на все нервные клетки. Медикаменты тоже обладают низкой специфичностью. Кроме того, скорость их работы ниже, чем у головного мозга.
Позже Крик в своих лекциях предположил, что свет обладает способностью избирательно воздействовать на клетки ЦНС. Но в то время еще не существовало методик, способных заставить нейроны реагировать на световое излучение. Они появились только через четверть века благодаря открытиям биологов и развитию генной инженерии.
В 1971 году ученые Калифорнийского университета открыли бактериальный родопсин — мембранный белок архей, чувствительный к свету. Спустя пять лет российские ученые, изучавшие реакцию одноклеточных зеленых водорослей на свет, обнаружили, что за этот процесс отвечает похожий родопсин. Позже светочувствительные белки зеленых водорослей получили название «канальные родопсины» (каналородопсины) из-за их способности работать как светозависимые ионные каналы.
Каналородопсины позволяют зеленым водорослям двигаться в сторону света. При экспрессии этих белков в нейронах животных или людей они в ответ на свет начинают функционировать как ионные каналы — мембранные рецепторы, регулирующие активность нервных клеток. Под воздействием света каналородопсины быстро и безопасно включают или выключают нейроны. Сегодня эти белки — главные инструменты оптогенетики.
Родоначальник оптогенетики — американский нейробиолог Карл Дайссерот, опубликовавший в 2007 году революционную работу о создании оптического нейронного интерфейса. В ходе эксперимента на мышах он доказал, что с помощью введения в ЦНС модифицированного ChR2 (каналородопсина-2) можно управлять нейронами дистанционно, «не залезая в мозг», а просто воздействуя на них светом. До этого эксперимента нейроны контролировали путем глубокой стимуляции мозга (deep brain stimulation) электродами, физически введенными в ЦНС.
Технология Дайссерота позволила избирательно воздействовать на определенные нейроны за миллисекунды.
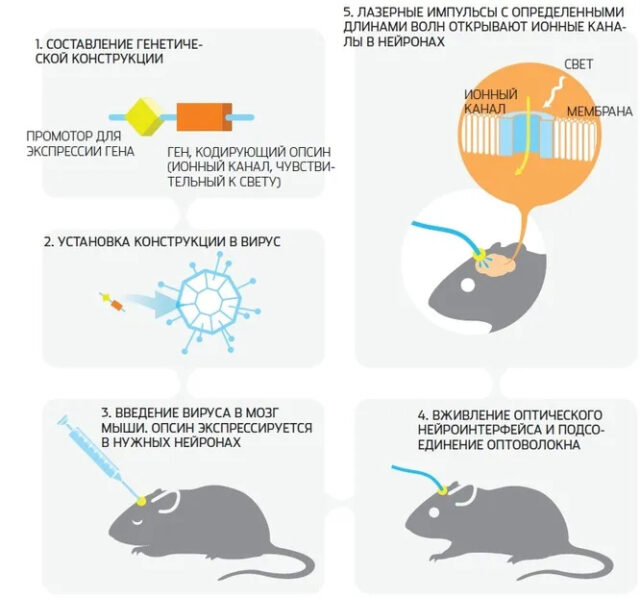
Оптогенетические эксперименты на мышах проходят по следующему алгоритму:
- Создается генная конструкция, состоящая из промотора и гена, кодирующего светочувствительный белок. Промотор нужен для того, чтобы белок экспрессировался только в определенном типе нервных клеток.
- Генная конструкция помещается в вектор — систему доставки, которая транспортирует генетический материал к целевым клеткам. Доставщиками выступают вирусы, с легкостью проникающие в клетки хозяина.
- Вирус вводится в мозг мыши, и белок начинает экспрессироваться в целевых нейронах.
- На голове грызуна устанавливается оптоволоконная система, которая доставляет пучки света к выбранной области мозга.
- Под воздействием светового излучения определенной длины целевые нейроны проявляют ту или иную реакцию.
Сегодня ученым известны специфические свойства родопсинов различного происхождения, в том числе животного. В арсенале оптогенетики множество светочувствительных инструментов с разными функциями, что позволяет решать широкий спектр задач, возбуждая нейроны или снижая их активность.
У оптогенетики есть лечебный потенциал для целого ряда неврологических заболеваний и психопатологий, включая болезнь Паркинсона, эпилепсию, болевые синдромы, зависимости, шизофрению. Огромные надежды ученые возлагают на оптогенетическое протезирование дегенеративной сетчатки: разработаны инновационные методы восстановления зрения, и некоторые из них уже тестируются на людях.
Оптогенетика — это не только лечебная методика, но и прогрессивный метод исследования мозга, с помощью которого получена принципиально новая информация о нейронных сетях, когнитивных функциях, моторике, работе сердца и других органов. Исследование нейробиологов Массачусетского технологического института выявило область мозга, которая связывает чувства с воспоминаниями. Ей оказалась нейронная цепь, соединяющая гиппокамп и миндалину. Результаты этого исследования могут помочь в лечении посттравматического стрессового расстройства.
Трансформация клеток в фоторецепторы
К главным причинам полной или частичной утраты зрения относятся наследственные дегенеративные заболевания сетчатки (внутренней оболочки глаза), которая играет ключевую роль в поддержании зрительной функции. Существует много таких патологий, и каждая может привести к потере зрения. Самая распространенная причина слепоты в развитых странах — пигментный ретинит, и именно на его лечении сосредоточено большинство оптогенетических испытаний.
Сетчатка имеет слоистую структуру и состоит из пяти видов клеток, включая фоторецепторные, биполярные и ганглиозные. Фоторецепторные клетки — нейроны первого порядка в зрительном пути: они инициируют передачу визуальных сигналов в сетчатке. От фоторецепторов визуальные сигналы сначала передаются биполярным клеткам, а после — ганглиозным.
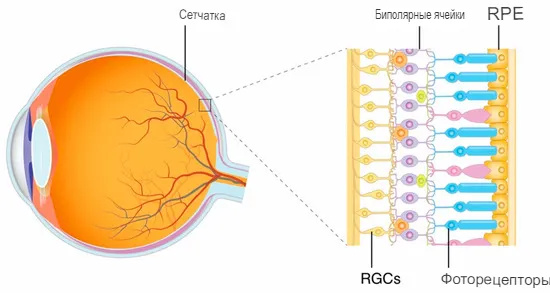
Из всех клеток сетчатки только фоторецепторы чувствительны к свету, поэтому именно от их функционального состояния зависит зрение.
В ходе дегенерации сетчатки первыми повреждаются и гибнут фоторецепторы, которые подразделяются на палочки и колбочки. Палочки воспринимают черно-белое изображение, колбочки — остальные цвета. Известно, что в процессе гибели фоторецепторов часть колбочек остается неповрежденной, и воздействие на них — одна из стратегий оптогенетики. Однако у этой стратегии есть существенный недостаток: точно неизвестно, как долго «живут» сохранившиеся колбочки.
Более надежные мишени для оптогенетики — биполярные и ганглиозные клетки, которые сохраняются после гибели фоторецепторов. В большинстве случаев именно на эти нейроны направлена оптогенетическая терапия.
Сохранившиеся биполярные и ганглиозные нейроны трансформируют в светочувствительные клетки, то есть заставляют их работать так, как работали фоторецепторы.
Для решения этой задачи в биполярные или ганглиозные клетки вводятся гены, кодирующие светочувствительные белки. Особенно надежна трансформация ганглиозных клеток, так как они сохраняются даже на поздних стадиях дегенерации сетчатки.
Кроме преобразования выживших нейронов сетчатки в светочувствительные клетки, тестируются и другие методы оптогенетики: воздействие на нейроны головного мозга, от которых зависит работа сетчатки, использование родопсинов при конструировании донорских фоторецепторов.
Еще одна технология генной терапии для лечения глаз — замена дефектных генов на здоровые. Если заболевание вызвано каким-то генетическим дефектом, его можно вылечить или облегчить с помощью введения в целевые клетки рабочей копии дефектного гена. Такой метод генотерапии эффективен при многих наследственных болезнях, но у него есть ограничение: методику можно применить только в том случае, если известен дефектный ген. Почти у половины пациентов, проходящих генетическое тестирование, не удается установить точную генетическую причину болезни.
У оптогенетики такого недостатка нет: эффективность методики не зависит от генотипа. Например, на сегодняшний день известно более 70 генов, мутации которых запускают развитие пигментного ретинита. И при поломке любого из этих генов оптогенетика позволит восстановить зрение.
Клинические испытания
В доклинических испытаниях оптогенетика показала эффективность при пигментном ретините и глаукоме. Способность методики восстанавливать зрение при дегенерации сетчатки была доказана еще в 2006 году в эксперименте на мышах с погибшими фоторецепторами. С помощью оптогенетики ученые трансформировали выжившие нейроны сетчатки в светочувствительные клетки, что восстановило ее способность кодировать световые сигналы и передавать их в зрительную кору мозга.
Глаукома характеризуется гибелью ганглиозных клеток, что приводит к ухудшению зрения и слепоте. Существует версия, что определенные зрительные центры в головном мозге, включая верхний колликулюс, поддерживают работу и выживаемость ганглиозных клеток. В этом случае стимуляция нейронов зрительных центров может замедлить гибель ганглиозных клеток и прогрессирование глаукомы. Команда белгийских ученых проверила эту теорию на мышах с индуцированной глаукомой.
Оптогенетическая стимуляция нейронов верхнего колликулюса снизила гибель ганглиозных клеток на 63%.
На животных также тестируется пересадка донорских фоторецепторов. Основная проблема, с которой сталкиваются исследователи, — поддержание светочувствительности пересаженных клеток. Оптогенетика позволяет ее решить. Введение микробного родопсина в предшественника фоторецепторов новорожденных мышей и их пересадка слепым грызунам привела к восстановлению светочувствительности сетчатки и зрения.
Проводятся и клинические испытания оптогенетики. В настоящее время тестируются четыре оптогенетических метода для лечения пигментного ретинита, некоторые уже продемонстрировали эффективность в восстановлении зрения.
Биофармацевтическая компания GenSight Biologics разработала оптогенетический препарат GS030, который однократно вводится в глазное яблоко. Препарат содержит ген, кодирующий светочувствительный белок ChrimsonR-tdT. Экспрессия этого белка делает ганглиозные клетки чувствительными к свету. Кроме введения препарата, лечение заключается в ношении специальных очков, которые создают высокоинтенсивные световые импульсы. GS030 присвоен статус орфанного препарата в США и Европе.
В 2021 году был опубликован отчет о клиническом случае пациента с пигментным ретинитом, у которого частично восстановилось зрение после низкодозированного лечения препаратом. После этого стартовало клиническое испытание, направленное на оценку эффективности и безопасности высоких доз GS030. Девять пациентов были разделены на три группы, каждая из которых получала определенную дозу препарата. В 2023 году стали известны первые результаты испытания.
Пациенты, до лечения практически ничего не видевшие, через год смогли определять свое местоположение и считать предметы. Наилучшие результаты наблюдались в группе самых высоких доз.
Высокодозированное лечение GS030 оказалось не только эффективным, но и довольно безопасным. Наиболее распространенным побочным эффектом было легкое внутриглазное воспаление, которое быстро устранялось с помощью кортикостероидов.
Дальнейшие исследования будут направлены на тестирование высоких доз GS030 в расширенной когорте.
Компания Nanoscope Therapeutics разработала оптогенетический препарат vMCO-010, направленный на трансформацию биполярных клеток в фоторецепторы. Препарат восстанавливает зрение в различных цветовых средах без использования искусственного освещения, поэтому пациентам не нужно носить дополнительные приспособления.
В 2020 году стали известны результаты исследования, в котором тестировались разные дозы препарата.
У всех 11 испытуемых с прогрессирующим пигментным ретинитом наблюдалось значительное дозозависимое улучшение остроты зрения.
FDA присвоила vMCO-010 статус орфанного препарата для лечения пигментного ретинита и болезни Штаргардта — наследственной глазной патологии, стартующей в детском и подростковом возрасте и приводящей к слепоте. В июле 2021 года лекарство было введено первому пациенту с этим заболеванием.