Преодолевая иммунные барьеры: успехи современной трансплантологии
За полтора века своего существования трансплантология добилась значительных успехов. В середине ХХ века врачи научились пересаживать органы от неродственных доноров, в начале ХХI — пересаживать искусственно выращенные органы, а в прошлом году впервые трансплантировали человеку сердце свиньи. Несмотря на эти достижения, пересадка органов до сих пор является сложнейшей операцией, связанной со множеством проблем. Одна из главных — это противодействие иммунной системы пациента. Биолог Светлана Бозрова рассказывает, каким образом трансплантологи пытаются обойти иммунную агрессию и «настроить» органы под конкретного человека.
Пересадкой органов человечество интересовалось на протяжении всей своей истории. Упоминания об этом можно найти, например, уже в папирусе Эберса II тысячелетия до н. э. Во времена Средневековья о пересадках Европе пришлось забыть: христианство запрещало производить вскрытия, тело человека считалось неприкосновенным.
Свое начало экспериментальная трансплантология берет в XIX веке. В 1869 году швейцарец Жак Луи Реверден успешно пересадил лоскут кожи человека. Этой технологией пользовались во время Первой мировой войны. С началом Второй мировой пересадки кожи снова стали актуальны. Уникален случай пилота Чарльза Вудса, чей самолет, перевозивший топливо, взорвался при приземлении. Он получил больше 70% ожогов тела и лица и считался практически умершим. Однако спустя шесть недель ему пересадили кожу от другого погибшего солдата и через два года он уже жил своей привычной жизнью.
Долгое время врачи могли пересаживать только кожу. Лишь в 60-х годах ученые поняли, что для пересадки целых органов необходимо каким-либо образом повлиять на иммунную систему пациента. В 1962 году Джозеф Мюррей смог впервые пересадить пациенту почку от неродственного донора с использованием иммуносупрессантов.
Следующая веха в истории трансплантологии — попытка пересадить человеку искусственно выращенный орган.
В 2008 году Паоло Маккиарини пересадил искусственную трахею женщине, чей собственный орган пострадал от туберкулеза. Операция прошла успешно. Однако через какое-то время выяснилось, что хирург подтасовывал научные данные и не провел необходимые перед работой с человеком исследования на животных, что ставит под сомнение его успех.
В 2022 ученые и врачи из Мэрилендского университета впервые провели трансплантацию сердца от свиньи человеку. Несмотря на то, что 57-летний пациент скончался через два месяца после операции, это невероятное достижение для медицины. Такая трансплантация стала доступна благодаря технологии редактирования генома CRISPR. Животному-донору предварительно отредактировали 10 генов, чтобы орган не отторгался иммунной системой человека и подходил ему по размерам (Рис. 1).
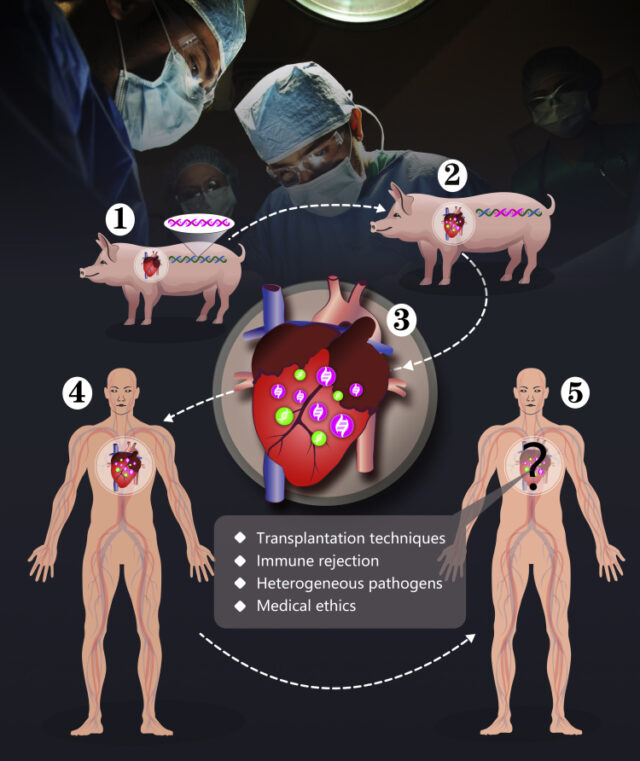
Где же наука о пересадке находится сегодня? Что можно сделать, чтобы после пересадок органов выживало больше пациентов?
Какие бывают трансплантации?
Пересадки бывают очень разные. Всего типов трансплантации четыре — их разделяют в зависимости от того, кто выбран в качестве донора.
Можно пересадить человеку кусок кожи от него самого — так часто делают при ожогах. В таком случае называться это будет аутотрансплантацией. Если используют биологический материал от генетически идентичного организма (например, близнеца), то это — изотрансплантация.
Если какую-либо часть тела берут от представителя того же вида, но не генетически идентичного, пересадка называется аллотрансплантацией. Самая сложная с точки зрения преодоления отторжения — ксенотрансплантация, когда материал пересаживают от представителя другого вида. Например, от свиньи человеку.
Очень важно при пересадке не просто перенести орган от одного пациента (или животного) другому, а добиться того, чтобы орган оставался неповрежденным иммунной системой реципиента как можно дольше. В противном случае начинается отторжение и все усилия врачей оказываются напрасными.
Увы, по статистике американских врачей, лишь 54% процента от пересаженных почек спустя 10 лет все еще служат новым хозяевам.
Такая цифра не сильно радует, ведь это говорит о том, что остальные 46% либо скончались, либо были вынуждены делать повторную операцию и искать нового донора.
Ученые постоянно работают над тем, чтобы процент прижившихся на долгое время органов рос. Что, помимо разработок новых иммуносупрессивных терапий, может улучшить ситуацию? Вот основные стратегии:
- развитие института донорства;
- создание искусственных органов;
- ксенотрансплантация.
Если развитие института донорства — это скорее социальный вопрос, то следующие два пункта — вопрос научный и медицинский. Искусственные органы и ксенотрансплантация могут здорово улучшить положение вещей в трансплантологии, в том числе в плане преодоления отторжения пересаженных органов.
Ксенотрансплантация недавно имела невероятный успех, как упомянуто выше. Хотя пациент все же скончался, перспективы перед ней открыты огромные. Помимо того, что пересаженные от другого вида органы можно определенным образом «настроить» под пациента, благодаря чему риск отторжения снижается, сам поиск донора тоже значительно облегчается.
Какие же механизмы иммунитета мешают успешной пересадке и что с ними можно сделать?
Кто виноват?
Иммунная система учеными подразделяется на врожденный и приобретенный иммунитет. Врожденный иммунитет — это команда быстрого реагирования. Его клетки действуют молниеносно сразу же после попадания в организм чего-то чужеродного. Именно благодаря этой первой линии обороны мы чувствуем, как у нас поднимается температура при ОРВИ и гриппе, ощущаем боль и набухание в порезанном пальце.
Второй же эшелон — адаптивный иммунитет. Его клетки не столь стремительны, зато гораздо более точны. Если под раздачу врожденного иммунитета попадает вообще все чужое для организма и его можно сравнить со взрывом, то действие адаптивного иммунитета больше напоминает снайпера. Его клетки тщательно и долго выслеживают врага и бьют именно по нему, не разрушая практически ничего вокруг.
Именно адаптивный иммунитет отвечает за прививки — организм обучается бороться с конкретной инфекцией.
Человеку необходимы обе ветви иммунитета. Поломка в какой-либо из них, развитие иммунодефицита — тяжелейший удар по организму. Вспомним хотя бы ВИЧ, из-за которого может развиться синдром приобретенного иммунодефицита.
Однако иногда иммунитет может человеку мешать. Пересадка органов — тот самый уникальный случай. Дело в том, что пересаженный орган (есть речь не идет о пересадке от генетически идентичного донора) распознается иммунной системой как чужеродный для организма элемент. Точно так же работает система и в обратную сторону: для иммунных клеток, оставшихся в пересаженном органе, организм пациента — враг.
На абордаж!
Иммунные системы донора и реципиента схлестываются в битве. Клетки-макрофаги пациента активируются и налаживают производство воспалительных цитокинов, которые отвечают за развитие воспаления.
Другие клетки, натуральные киллеры, отвечающие за противораковую защиту в организме, начинают активно работать из-за того, что к ним не поступает успокаивающий их сигнал о том, что все клетки в их окружении «свои», а от трансплантанта поступает сигнал, что его клетки «чужие».
Кроме того, у пациента активируется система свертывания крови, поскольку клетки трансплантанта не могут послать этой системе достаточно сильный сигнал о том, что активироваться не надо. Это ведет к закупорке сосудов и отторжению пересаженного органа.
Важнейший компонент врожденного иммунитета, антитела, тоже не остается в стороне. Если речь идет об органе от свиньи, антитела активно связывают такой трансплантант за счет того, на поверхности много молекул, к которым им очень легко «прицепиться». Такая реакция часто ведет к отторжению.
Чужакам тут не место
В опасной для пациента битве с трансплантантом адаптивный иммунитет не остается в стороне. Он высокоточно бьет по своим целям, так как умеет различать свои и чужие клетки за счет специальных молекул MHC.
В случае с аутотрансплантацией угрозы отторжения из-за агрессии адаптаптивного иммунитета нет: все клетки пересаженного органа несут на себе родную МНС. При аллотрансплантации этот риск минимизируют — МНС трансплантанта должны быть максимально похожи на хозяйские. Выше всего угроза при ксенотрансплантации.
Ксенотрансплантант оказывается в опасности сразу со многих сторон. Во-первых, В-клетки людей с высокой чувствительностью к чужому MHC с ажиотажем его атакуют. Во-вторых, между адаптивным и врожденным иммунитетом образуется порочный круг: Т-клетки активируют врожденный иммунный ответ, запуская его патологические реакции.

И что делать?
Генное редактирование, как оказалось, может творить чудеса. Ученым пришла в голову логичная идея выбрать самые реактивные белки (вызывающие наиболее сильный иммунный ответ у пациента) и модифицировать их таким образом, чтобы интенсивность иммунного ответа была максимально снижена.
Эксперимент проводили на приматах, которым пересаживали органы от свиней. В качестве модифицируемого белка ученые выбрали С-реактивный белок (СРБ) свиней, на который врожденный иммунитет приматов дает очень сильный ответ. В результате генного редактирования он стал неотличим от С-реактивного белка приматов.
Сделав инъекцию такой ДНК в яйцеклетку свиньи, ученые создали модифицированную особь с человеческим СРБ. И это сработало!
Однако победу праздновать было еще рано — реакция сверхострого отторжения не была полностью ликвидирована. Дополнительное генетическое редактирование, в ходе которого с поверхности трансплантированных клеток убрали галактозу — другую реактивную молекулу, значительно улучшило ситуацию.
В начале статьи мы упоминали современную технологию редактирования с помощью системы CRISPR-Сas9. С ее помощью с поверхности свиных клеток убрали не только галактозу, но и ее модификации. Именно этот подход помогает особо чувствительным пациентам использовать свиные органы. Генное редактирование позволяет не только снизить иммунный ответ у пациентов, но и управлять им. Врачи модифицировали клетки трансплантанта таким образом, чтобы они усиливали противовоспалительный ответ и обладали антиоксиддантным действием.
Чтобы победить атаку Т-клеток на трансплантант, ученые закодировали клетки донора так, чтобы они производили специальные антитела, блокирующие другие молекулы. Выбор мишени был прост — белки, наиболее активно участвующие в отторжении органа. Благодаря этому пациентам можно будет даже не использовать препараты, подавляющие иммунитет после пересадки.
Химеры
Помимо стремительно развивающегося генного редактирования, ситуацию улучшают также создание химер, пересадка донорского тимуса и выращивание «идеальных» доноров.
«Создание гематопоэтических химер» — звучит страшно. Суть этого подхода в образовании у пациента клеток крови с генетическим материалом и донора, и реципиента. Пациенту подсаживают стволовые клетки крови от будущего донора и ждут, пока те созреют. В процессе созревания новые клетки обретают толерантность (то есть становятся неагрессивны) одновременно к клеткам донора и реципиента.
Преимущество такой терапии в том, что она существенно менее токсична, чем угнетающие иммунитет препараты. У пациента остается сохранным собственный иммунитет, а значит, он менее подвержен инфекциям.
Ученые получили много положительных результатов при пересадке органов от человека к человеку с использованием смешанного химеризма. С пересадкой человеку от других видов дело обстоит хуже, хотя попытки использовать эту стратегию тоже были. Увы, даже при соблюдении всех правил операции отторжения в таких случаях все же происходят.
Масштабные пересадки
Тимус — небольшой орган, в котором развиваются Т-клетки адаптивного иммунитета. В нем удаляются самые агрессивные к собственному организму клетки и те, которые не способны качественно работать. Находится тимус в районе грудины над сердцем.
Идея пересаживать реципиенту не только необходимый орган, но и тимус от донора, оказалась многообещающей. За счет такой трансплантации удается достичь толерантности Т-клеток*. Этот метод подходит лишь для ксенотрансплантантов или аллотрансплантантов от погибшего человека, поскольку для такой системы требуется неживой донор. Ведь отнять тимус у живого существа и сохранить ему качественную жизнь невозможно.
Тимус обычно подсаживают под капсулу почек. Реципиент живет дальше с двумя тимусами, и пересаженный орган не отторгается. Пока что эксперименты такого рода провели на свиньях — при аллогенной пересадке сердца с одновременной пересадкой тимуса ученые добились того, что сердце прижилось очень хорошо.
Недостаток этой техники в том, что пациент после пересадки может стать гораздо более уязвим к инфекциям.
Прорыв 2022 года — создание гибридного тимуса.
Для пересадки органа от свиньи к человеку такой тимус выращивают в мыши, у которой отсутствуют все иммунные клетки. Клетки эпителия тимуса реципиента (человека) подсаживаются в донорский (свиную) тимус, и весь этот комплекс созревает в организме мыши. Полученные таким образом Т-клетки человека, во-первых, не агрессивно реагируют на пересаженный от свиньи орган, во-вторых, гораздо более сильны в плане защиты организма от инфекций.
На любой вкус и цвет
Часто при пересадке орган по каким-то параметрам для реципиента хорош, а по каким-то не очень. Например, донор-свинья может страдать от ретровирусов, уже встроившихся в его геном, или же его органы могут не подходить для пересадки по размеру. Ученым удалось решить обе эти проблемы: с помощью технологии CRISPR-Cas9 у донора перед пересадкой успешно «почистили» ДНК от ретровирусов. Размер органов тоже можно регулировать, выбирая ту или иную породу животных. Пересадки почек от маленьких пород свиней бабуину оказались в разы успешнее, чем от больших.
Можно регулировать и более тонкие параметры, чем размер органа. Например, при генетической замене у свиньи-донора белков, отвечающих за свертывание крови, на белки бабуина-реципиента пересадка проходила гораздо лучше. Таким образом ученым удалось избежать излишнего образования тромбов и ишемии в пересаженном органе.
На пороге больших открытий
Наука о пересадке органов быстро движется вперед. Кто мог подумать, что врачам удастся удачно пересадить орган от свиньи человеку? Однако для первого раза все прошло весьма успешно!
Все рассмотренные направления исследований направлены на то, чтобы получивший орган пациент мог не принимать осложняющие жизнь иммунодепрессанты и жить с пересаженным органом как можно дольше.
Пока что не все из этих перспективных технологий вышли в клиническую практику. Предсказать, какая именно совершит прорыв в медицине, невозможно. Поэтому пожелаем ученым удачи и большого количества интересных идей!
