Химическое оружие, антитела и липидные пузырьки. Как ученые приручили токсины для борьбы с раком
Рак — одна из самых пугающих и при этом самых распространенных групп заболеваний: на протяжении жизни с ним сталкивается едва ли не каждый пятый. «Нож» разбирается в том, как жертвы химического оружия, иммунная система хомячков и мышей, а также новейшие методы таргетированной доставки лекарств помогали разрабатывать новые онкологические препараты.
Никто не застрахован от онкологических заболеваний, будь то кассирша «Пятерочки» или депутат. Рак не различает либералов и консерваторов, богатых и бедных, верующих и атеистов. Более того, раковые клетки есть даже у здоровых людей, но время их жизни ничтожно — в норме наш иммунитет сам вычисляет и убивает больные клетки. Кроме того, онкологические заболевания бывают не только у человека, но и у других видов животных.
Недавно в Москве разразился скандал: жители одного из домов требовали выселить онкобольных детей из подъезда, думая, что рак заразен. К счастью, для людей это не так. Однако есть существа, которых трансмиссивные (заразные) формы рака поставили на грань вымирания, — тасманские дьяволы. Их поражает особый вид лицевой опухоли, которая передается при контакте.
Впервые случаи рака описали еще древнеегипетские врачи, но неизвестно, какой процент людей за всю историю существования человека как вида умер от онкологических заболеваний. Примечателен случай Наполеона Бонапарта. Долгое время считалось, что он был отравлен: либо намеренно — англичанами, охранявшими его на острове Святой Елены, либо случайно — вдыхая летучие метаболиты плесневых грибков, в которые входил мышьяк, содержавшийся в красках для обоев. Однако настоящую причину смерти Наполеона выяснили лишь во второй половине ХХ века: оказалось, что император Франции умер от рака желудка. Этот пример иллюстрирует, насколько низким был уровень диагностики, доступный до ХХ века, даже у относительно обеспеченных людей.
Долгое время были известны лишь хирургические методы лечения онкозаболеваний. Другой вариант, уже на поздних стадиях, — паллиативная терапия для уменьшения страданий безнадежно больных пациентов.
Первый значительный шаг в лечении рака помогло сделать, как ни иронично, химическое оружие.
Во время Первой мировой войны врачи обнаружили у солдат, отравленных ипритом, аномально низкий уровень лейкоцитов.
Изначально иприт разрабатывали как оружие, отравляющее вещество общеядовитого действия. Он относится к алкилирующим агентам — высокореактивным веществам, которые соединяются с азотистыми основаниями, «буквами», составляющими ДНК. Ферменты, которые участвуют в удвоении цепи в период клеточного деления, не могут продолжить работу, наткнувшись на алкилированное основание. Это запускает самовосстановление ДНК, которое в большинстве случаев не может произойти из-за огромного расхода кофермента НАД. Клетки, целостность ДНК которых восстановить не получается, запускают апоптоз — процесс клеточного самоубийства.
На основе иприта ученые синтезировали целый ряд различных веществ. Одно из них, азотистый иприт, впервые применили для химиотерапии лимфомы у человека. О личности пациента известно мало — во всех документах он фигурировал как JD; из обнародованных сведений мы знаем лишь то, что это был токарь польского происхождения, работавший на шарикоподшипниковом заводе. Перед экспериментальной химиотерапией он прошел курс рентгеновского облучения. Кроме того, из-за военной секретности (в конце концов, это же химическое оружие! В человека! Инъекционно!) название «азотистый иприт» нигде не упоминалось, и долгое время во всех отчетах лекарство фигурировало под названием «вещество Х» или «лимфоцид».
По сей день многие исторические источники, даже те, которые используют данные из рассекреченных документов, путаются, какой же из азотистых ипритов был применен в данном случае. Основные «претенденты» — HN3 и HN2.
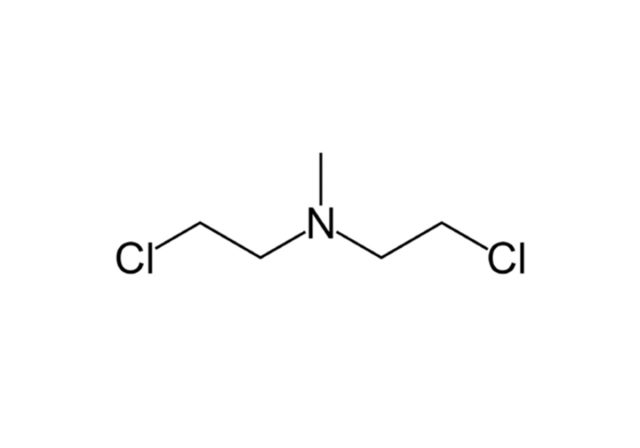
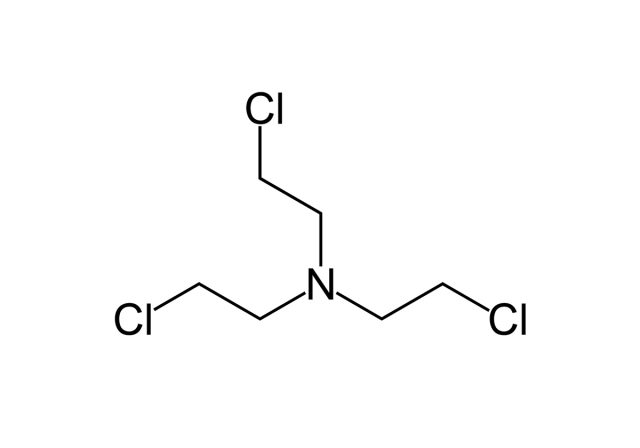
Пациенту лечение помогло, но ненадолго: в итоге он все-таки умер от лимфомы, так как изначально выбирали безнадежно больного добровольца. В те времена знали только о способности ипритов убивать лимфоциты. Однако было мало известно об их более глубоком молекулярном действии: если клетка выживала после такого удара и системы восстановления могли исправить поврежденную ДНК, возникал риск, что выздоровевшая клетка сама по себе станет раковой!
Тем не менее именно на основе ипритов в 1960-х годах был получен один из первых, если не первый, препарат для таргетной терапии рака, а именно рака простаты. Это вещество, производное стероидных гормонов, называлось «эстрамустин» и успешно использовалось в клинической практике.
Многие годы разработка противораковых препаратов была, по сути, разработкой таких клеточных ядов, которые убивали бы опухоль быстрее, чем остальной организм.
Ученые добивались, чтобы риск возникновения вторичного рака из-за повреждений ДНК здоровых клеток был минимальным.
Ситуация изменилась, когда ситуацию стали рассматривать с довольно неожиданной стороны — иммунологии. Ученые обратили внимание на разницу в «антигенном» составе мембран раковых и здоровых клеток: каких-то белков в пораженных клетках было больше, чем у здоровых, а какие-то пропадали. В 1970-х годах иммунологи Георг Кёлер и Сезар Мильштейн изобрели способ получения моноклональных [то есть произошедших от одной клетки. — Прим. ред.] антител в гибридомах — клетках, полученных слиянием мутантных линий миеломы и В-клеток иммунизированного животного.
Антитела — это молекулы, способные с высокой специфичностью связываться с одним определенным белком-мишенью (антигеном). На явлении высокоспецифичного связывания антитела с антигеном основано множество молекулярно-биологических методик, диагностических тестов, лекарственных терапий.
Иммунизация — это процесс, при котором лабораторному животному вводят небольшую порцию чужеродного белка, против которого его организм должен выработать антитела. В нормальных условиях наш организм реагирует на присутствие внутри себя инородных молекул и микроорганизмов так: иммунные клетки захватывают чужака, на котором нет «пропуска» — особой последовательности остатков углеводов, соединенной с молекулой, что-то вроде биологического штрихкода, индивидуального для определенного вида. Затем иммунные клетки разделяют вторженца на части и выставляют «трофеи» на мембрану клетки. Такая клетка, несущая на своей поверхности остатки чужих белков, называется антигенпрезентирующей. Они заставляют В-клетки вырабатывать антитела к антигенам.
Но дело в том, что нельзя просто показать клетке белок, чтобы она начала производить к нему антитела, — для этого в клетке должна произойти генетическая VDJ-рекомбинация. По сути, это биологический аналог перебора паролей путем подстановки случайных символов. Здесь тоже перебираются возможные последовательности фрагментов антител, пока не найдется конструкция, которая наиболее эффективно и селективно свяжется с антигеном.
Когда мы встречаемся с каким-то антигеном (например, белком оболочки вируса гриппа), в нашем организме, конечно, присутствуют антитела. Но проблема в том, что они вырабатываются множеством разных В-клеток и потому различаются по своей аминокислотной последовательности. Открытие же Кёлера и Мильштейна позволило получать множество антител с одинаковой специфичностью и, самое главное, одинаковой последовательностью аминокислот.
Дело в том, что все клетки-продуценты определенной клеточной линии происходят из клонов одной-единственной гибридомы, которую отбирают для каждого нового антитела.
Долгое время гибридомный метод использовали лишь как очередной удобный способ получения антител для различных нужд. Но всё изменилось в 1980-е, когда ученые уточнили антигенный состав мембраны Т-клеток. Оказалось, что, если заблокировать белок CD3 специфичным антителом, Т-клетка может погибнуть. Еще больше радости это открытие доставило онкологам, которые как раз искали средство для эффективного лечения Т-клеточных лейкозов. Таким средством стал муромонаб — моноклональное антитело, которое стали использовать еще и для профилактики отторжения донорских органов при пересадке.
Сейчас для клинического использования одобрено несколько десятков моноклональных антител. Каждое специфично к тому или иному белку, встречающемуся в раковых клетках. Однако даже эта терапия имеет свои недостатки. Первые антитела были в основном основаны на мышиной последовательности иммуноглобулина, а следовательно, могли вызывать образование антител второго порядка. Еще один недостаток, который устранили только в наше время, — несовпадение того самого «штрихкода» с человеческим. Эту проблему смогли решить, использовав в качестве продуцента генетически измененные клетки СНО (яичник китайского хомячка) вместо гибридов.
Кроме того, антитела не оказывают прямого цитотоксического действия, то есть не вызывают некроз внутри злокачественной клетки. Для решения этой проблемы пришлось изобрести новый класс препаратов — конъюгаты лекарство-антитело (antibody-drug conjugate, или ADC).
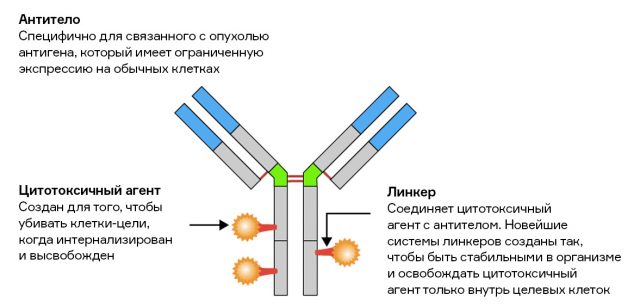
Удивительно, но «пришивать» различные молекулы к антителам научились еще до того, как разработали методику получения их однородной популяции, то есть до открытия гибридом. Суть в том, чтобы совместить плюсы обоих подходов к убийству раковых клеток — высокую токсичность классической химиотерапии и высокую селективность моноклональных антител.
Первым лекарством, которое разрешили использовать в клинической практике, был «Милотарг», препарат для лечения острой миелоидной лейкемии. Он представлял собой комплекс из антитела к белку CD33 и цитотоксичного антибиотика озогамицина. Сейчас этот класс препаратов крайне перспективен, но одобрено меньше десятка его представителей.
Недостаток такого подхода — явление деконъюгации, когда «линкер» (небольшая молекула-мостик, соединяющая антитело с цитотоксичным веществом) распадается. Это может происходить спонтанно либо под воздействием ферментов. Однако второй недостаток, ферментативную деконъюгацию, в будущем можно превратить в достоинство. Существуют разработки, в которых препарат высвобождается именно с помощью внутриклеточных ферментов, когда комплекс антитела с белком-антигеном интернализируется. Кроме того, сейчас разрабатывают так называемые иммунолипосомы — эти липидные «пузырьки-контейнеры», соединенные с антителами. Они доставляют регуляторные РНК или ДНК в определенные виды раковых клеток.
Радоваться стоит, но не сильно. Такой подход к лечению рака довольно эффективен и перспективен. Но нужно помнить, что любая таргетная (прицельная) терапия работает, только если выявлены четкие различия между антигенным составом или метаболизмом в клетках конкретного типа рака и здоровыми клетками.
