Бактерия по имени Синтия и генетические ножницы: чем занимается синтетическая биология и как она изменит нашу жизнь
В научном мире революция: на смену генной инженерии приходит синтетическая биология. Ее представители заявляют, что будут синтезировать новые биосистемы, которых нет в природе, и изменять свойства уже существующих организмов. Это позволит людям эффективнее диагностировать и излечивать разные заболевания, быстро производить медикаменты и вакцины, создавать высокотехнологичные материалы. Рассказываем, как появилась синтетическая биология, какие задачи она уже решает и чего нам ждать от нее в будущем.
Синтетическая биология — продвинутая генная инженерия
Предшественник синтетической биологии — генная инженерия, которой уже около 40 лет. За это время ученые получили прямой доступ к генетическому коду, научились модифицировать ДНК, разрезать ее на фрагменты и воссоздавать в лаборатории. Но несмотря на огромный объем информации о геноме, способность генной инженерии быстро и надежно создавать биосистемы оставалась ограниченной.
Эта задача оказалась по плечу новому научному направлению — синтетической биологии. Она объединяет молекулярных биологов, инженеров и программистов, которые формируют биологические системы с заданными функциями и свойствами, редактируют гены и программируют клетки так, как нужно человеку.
Развитие синтетической биологии ведет к тому, что разница между природным и рукотворным будет исчезать.
Синтетическая биология основана на трех инженерных принципах:
- Абстракция. Биологические системы имеют сложную структуру, поэтому их так трудно создавать. Принцип абстракции упрощает это: отсекается всё лишнее, а информация о биосистеме распределяется по нескольким уровням, подчиняющимся иерархии. Например, по уровням: ДНК → клетка → организм. На каждом уровне организуется независимая работа.
- Специализация. Раньше в работе молекулярных биологов не было специализации, один и тот же человек занимался проектированием и сборкой биосистемы. В синтетической биологии разработкой дизайна и сборкой занимаются разные специалисты.
- Стандартизация. В 2003 году в Массачусетском университете разработали стандарт BioBrick для взаимозаменяемых генетических деталей. После этого был создан Реестр стандартных биологических частей, в который входят более 2000 деталей: последовательности ДНК, белки и их элементы, рецепторы. Пользоваться реестром могут академические лаборатории, ученые, участники конкурса по синтетической биологии iGEM. Это позволяет исследователям быстро собирать надежные искусственные организмы.
С развитием синтетической биологии на смену стандартным лабораториям пришли виртуальные. Например, ECL — облачная лаборатория, доступ к которой генетики, химики и биологи получают через интернет. Чтобы провести эксперимент, исследователю достаточно выбрать на сайте сценарий работы с образцами, всё остальное сделает роботизированная техника.
Облачные лаборатории избавили исследователей от повседневной рутины и позволили им сосредоточиться на интеллектуальной работе. А еще они решили проблему воспроизводимости экспериментов, актуальную в генной инженерии. В роботизированном центре исследователь может повторить эксперимент дистанционно, нажав кнопку на своем компьютере.

С чего начиналась синтетическая биология
В ядре любой клетки содержится ДНК — макромолекула, которая хранит, передает из поколения в поколение и реализует генетическую программу.
Молекула ДНК складывается из двух цепей, закрученных по спирали. Цепи состоят из нуклеотидов, которые отличаются друг от друга азотистыми основаниями. Выделяют 4 их вида:
- A — аденин;
- G — гуанин;
- T — тимин;
- C — цитозин.
Азотистые основания образуют пары по принципу комплементарности: аденин всегда связывается с тимином, а гуанин — с цитозином. Именно благодаря этому принципу возможна передача генетической информации.
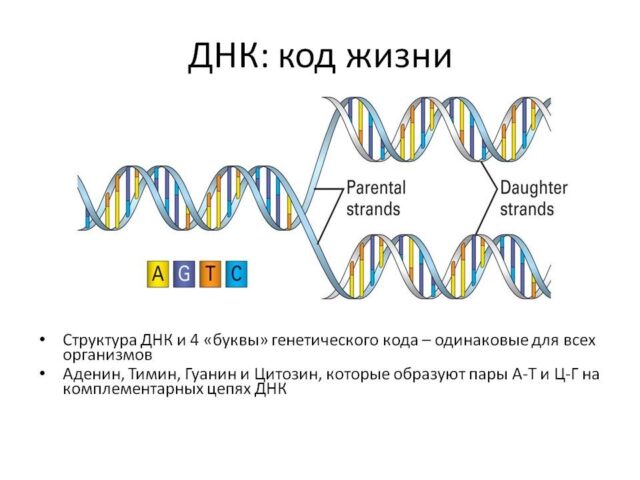
Но насколько идеален и разумен такой 4-буквенный код? Или он только один из возможных вариантов и выбран природой совершенно случайно? Что будет, если расширить код ДНК за счет дополнительных букв?
В 1989 году группа ученых во главе со Стивеном Беннером добавила в генетический код клетки два новых нуклеотида Р и Z — получилась 6-буквенная ДНК. Это достижение и стало началом развития синтетической биологии.
Дополнительные нуклеотиды гармонично вписались в винтовую структуру ДНК, новые основания были комплементарны друг другу и не искажали действия других нуклеотидов.
Целью Беннера было создать биосистему, где белки вырабатываются с избытком. 4-буквенная ДНК способна кодировать только 20 аминокислот, которые связываются друг с другом и образуют миллионы белков. 6-буквенная ДНК может кодировать в 10 раз больше аминокислот, а значит, и белков будет синтезироваться больше. Искусственные белки можно использовать для лечения болезней, улавливания углерода и сбора энергии.
Читайте также
Что такое улавливание углерода и может ли оно сделать авиатранспорт более экологичным
Генетические ножницы и биосенсоры-детективы: ключевые достижения синтетической биологии
1. Клетка с искусственным геномом
В 2010 году была синтезирована Синтия — бактерия с искусственным геномом. Это научное открытие вывело отношения человека с природой на новый уровень.
Синтию создали в лаборатории Института Венгера, который занимался метагеномными проектами: геном бактерии Mycoplasma mycoides клонировали и пересадили его в клетку близкого родственника — Mycoplasma capricolum.
Метагеномика — наука, которая изучает генетический материал сообществ микроорганизмов в совокупности. Например, объектами метагеномных проектов могут быть популяции, обитающие в почве, воде, организме животного, человека.
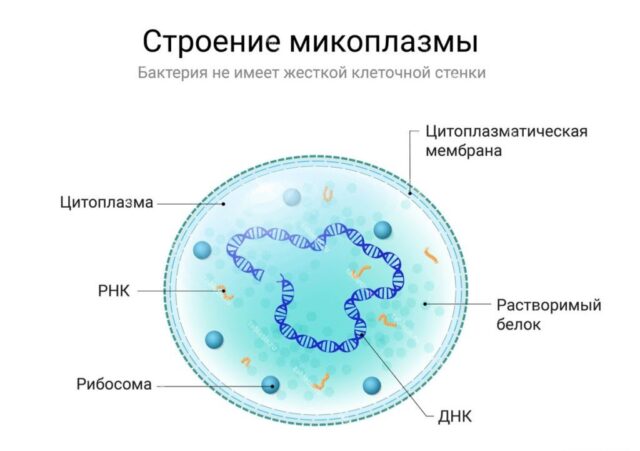
Микоплазмы были выбраны для эксперимента не случайно:
- у микроорганизмов очень короткий геном — около 1 млн нуклеотидов. Для сравнения — в геноме человека 3 млрд нуклеотидов. Чем короче геном, тем проще его синтезировать;
- в отличие от других бактерий с коротким геномом, микоплазмы способны обитать вне клеток хозяина, поэтому их можно выращивать в лабораторных условиях;
- у бактерий нет жесткой клеточной стенки. От внешней среды их отделяет только эластичная цитоплазматическая мембрана, через которую легко внедрить элементы искусственного генома.
Геном Mycoplasma mycoides синтезировали по частям и собирали в клетках разных организмов: сначала в клетках Escherichia coli (кишечная палочка), а после в клетках дрожжей. Когда ДНК собрали, ее поместили в клетку Mycoplasma capricolum.
Пересаженный геном утвердился в клетках-реципиентах. Гибриды практически ничем не отличались от настоящих Mycoplasma mycoides: они были так же похожи на яйцо, с такой же скоростью развивались, поглощали питательные вещества. Но существовать они могли только в лабораторных условиях.
Эксперимент доказал:
- в ДНК хранится программа развития и функционирования живых организмов;
- пересадки генома достаточно для того, чтобы получить биосистемы с нужными характеристиками.
Венгер пророчит своему открытию большое фармацевтическое будущее: биосистемы с искусственным геномом смогут в промышленных масштабах производить необходимые человечеству медикаменты и вакцины.
Удивительный факт о Синтии
В Синтии содержится зашифрованное послание тому, кто обнаружит бактерию в природе (возможно, в будущем она сможет жить вне лаборатории). Каждая комбинация из трех нуклеотидов в геноме Синтии обозначает цифру или латинскую букву. Расшифрованное послание включает в себя список создателей Синтии и три цитаты из литературы.
2. Система CRISPR-Cas9 — генетические ножницы
Генетические ножницы, или CRISPR-Cas9 — это технология редактирования генома, которая в 2020 году была удостоена Нобелевской премии по химии. Это событие уникально по двум причинам:
- впервые самую престижную научную награду получили только женщины, без мужчин: лауреатками стали Эммануэль Шарпантье и Дженнифер Даудна;
- с момента разработки CRISPR-Cas9 и до присуждения ученым премии прошло всего 8 лет. Как правило, этот срок составляет 20 и более лет.

Работа генетических ножниц основана на способности бактерий защищаться от бактериофагов — вирусов, которые поражают бактериальные клетки. Система CRISPR обнаружена почти у половины известных бактерий. Каждый раз, когда бактерия убивает бактериофага, она нарезает его ДНК на мелкую вермишель и прячет ее в системе CRISPR. Когда вирус снова атакует, бактерия использует информацию из CRISPR и синтезирует защитный белок Cas9, в котором содержатся элементы вируса. Если они совпадают с геномом нападающего, Cas9 разрезает захватчика — и бактерия вновь в безопасности.
Одно из перспективных направлений использования CRISPR-Cas9 — устранение мутаций генов, которые становятся причиной многих наследственных заболеваний.
Генетические ножницы позволяют удалять часть генома с мутацией и заменять ее на другую, не имеющую ошибок. Так клетка избавляется от дефекта в геноме и начинает нормально работать.
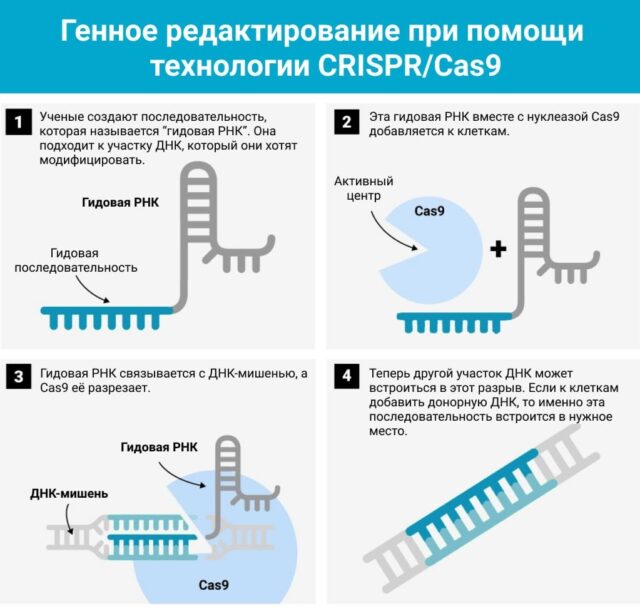
Для оценки эффективности и безопасности CRISPR-Cas9 проводятся клинические исследования, в том числе с участием людей. Например, в мае 2020 года технологию применили для лечения амавроза Лебера — наследственного заболевания сетчатки глаза, приводящего к слепоте. В клиническом испытании участвовали 6 человек, которые не могли различать цвета и видели только очертания предметов. 29 сентября 2021 года в Science вышла статья о том, что применение генетических ножниц значительно улучшило состояние двух добровольцев.
Возможно, в будущем генетические ножницы избавят человечество от таких наследственных заболеваний, как муковисцидоз, подагра, синдром Леша-Найхана.
Может быть интересно
Генетическая сага: 14 проблем первой генетической модифицикации детей
3. Перепрограммирование клеток
В процессе развития любая клетка проходит путь от недифференцированного состояния до специализированного. Недифференцированное состояние характерно для клеток бластоцисты — ранней стадии развития эмбриона. Такие клетки называют плюрипотентными или эмбриональными стволовыми. Они могут дать начало всем другим видам клеток.
Взрослея, клетки становятся специализированными, приобретают уникальную морфологию и начинают выполнять конкретные функции.
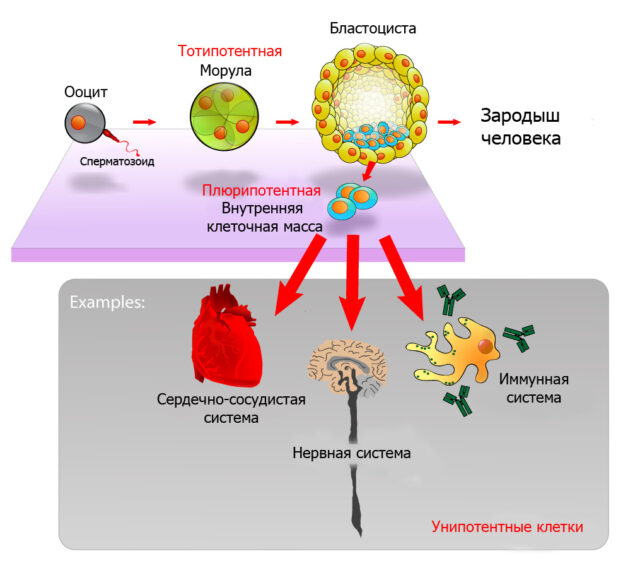
Плюрипотентные клетки можно перепрограммировать в специализированные — это доказали еще в 1952 году ученые Бриггс и Кинг. Они провели эксперимент, трансплантировав живые ядера из клеток бластулы в безъядерные лягушачьи яйца. А вот осуществить обратный процесс — превратить специализированные клетки в плюрипотентные — ученым долгое время не удавалось.
Всё изменилось, когда команда японского ученого Яманаки нашла в стволовых клетках несколько десятков генов, отвечающих за плюрипотентность. В 2006 году ученые внедрили в дифференцированные клетки (фибробласты) мыши вектор с 24 генами стволовых клеток. В итоге фибробласты дали колонии эмбриональных клеток.
Полученные клетки назвали ИПСК — индуцированные плюрипотентные стволовые клетки. За это открытие Синъя Яманака совместно с британским биологом Джоном Гердоном в 2012 году получил Нобелевскую премию.
Этот простой и быстрый способ получения стволовых клеток мгновенно взяли на вооружение десятки лабораторий по всему миру. Успешный эксперимент Яманаки дал толчок для нового открытия — перепрограммирования одного вида дифференцированных клеток в другой, минуя стадию стволовых клеток.
Удалось перепрограммировать экзокринные клетки поджелудочной железы в бета-клетки, которые отвечают за производство инсулина. Пока эта методика опробована только в лабораторных условиях, но в будущем ее планируют использовать для лечения сахарного диабета.
Также на основе ИПСК разрабатываются методы лечения болезни Альцгеймера, Паркинсона, онкологических заболеваний, патологий спинного мозга, последствий инфаркта миокарда.
4. Биосенсоры-детективы
Смертельные вирусы атакуют человечество на протяжении всей его истории. Многие из них уже не так опасны благодаря научным открытиям, развитию фармакологии, производству эффективных вакцин и противовирусных препаратов. Однако некоторые представляют угрозу для человека и сейчас: геморрагическая лихорадка Эбола, вирус Зика и COVID-19 унесли миллионы жизней. Это значит, что необходимо разрабатывать не только эффективные лекарства, но и точные, быстрые и доступные методы диагностики.
Феноменальной точностью и чувствительностью обладает ПЦР-метод, позволяющий увеличить тестируемый участок генома бактерий или вирусов в миллионы раз. Для получения достоверных результатов хватит всего одной бактерии или вирусной частицы в образце.
Однако ПЦР — довольно сложная технология: реакция проходит в три этапа и для каждого из них предусмотрен свой температурный режим. Таких условий можно добиться, только если использовать высокотехнологичное и дорогое оборудование. Но искать вирусы и бактерии хочется быстро, просто и не только в лабораторных условиях. Идеально, если аналитическая система будет иметь вид тест-полоски.
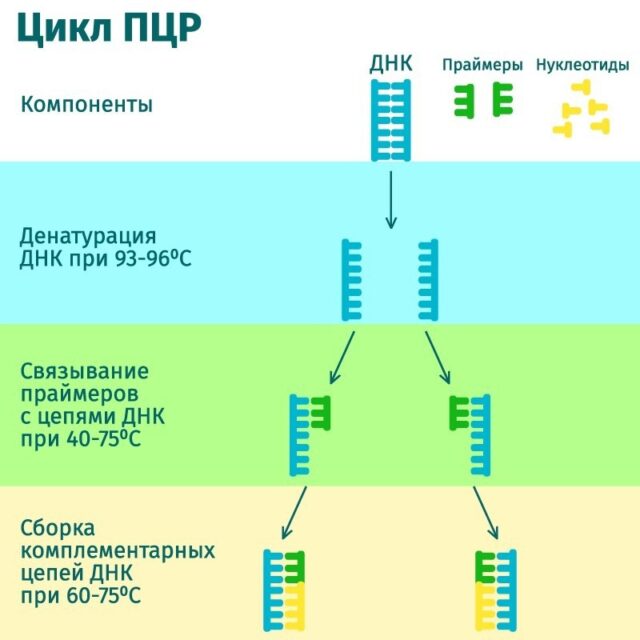
Благодаря синтетической биологии появляются методы, которые позволяют диагностировать патогены без привязки к дорогому и громоздкому оборудованию.
Один из таких методов — SHERLOCK, в основе которого лежит технология CRISPR-Cas13a.
Сыщиком в системе является белок Cas13a, который, в отличие от своего собрата Cas9, ищет не ДНК, а РНК вирусов. Cas13a не разрезает свою мишень, а полностью ее уничтожает. Поэтому он не подходит для редактирования генов, но полезен для диагностики.
SHERLOCK прошел много тестов и доказал, что он настоящий детектив. Аналитическая система обладает такой же чувствительностью, что и ПЦР, умеет различать генотипы вирусов, проводит генотипирование человека по бесклеточной ДНК, циркулирующей в плазме крови. А еще она может работать в виде тест-полосок.
Технология выдает результаты менее чем за 30 минут, а реакция проходит при постоянной температуре. Оптимальные условия — +37...+42°С, однако система работает и при более низкой температуре, просто результатов придется ждать дольше.
Интересные проекты iGEM
iGEM — это международный конкурс по синтетической биологии, в котором участвуют ученики старших классов, студенты и научные сотрудники Гарварда, Стэнфорда, Йельского, Принстонского, Калифорнийского, Массачусетского и других университетов.
В начале года участники формируют команду, которая в облачной лаборатории разрабатывает практические решения для медицины, ветеринарии, сельского хозяйства, пищевой промышленности. Всё это совмещается с планированием продаж и поиском инвесторов. Осенью команды собираются в Бостоне, чтобы представить свои проекты судьям и узнать, кто станет победителем.
Новый метод определения генотипа ВГС
Члены команды Moscow 2020 разработали аналитическую систему, которая могла бы распознавать генотипы HCV (гепатит С), за что получили золотую медаль iGEM.

Правильная и быстрая диагностика подтипа гепатита С важна для назначения правильной противовирусной терапии. В России проблема гепатита С стоит очень остро. Согласно официальной статистике ежегодно в стране от гепатита С умирает 17 тыс. человек, по неофициальной информации — в разы больше.
Известно 8 основных генотипов HCV. Каждый из них имеет свои особенности патогенеза и путей передачи. Команда Moscow 2020 создала в виртуальной лаборатории систему HaploSense, которая обладает высокой чувствительностью и аналитической скоростью: тип вируса можно распознать всего за час.
Не нужно дорогое и сложное оборудование — только компактный фотометр и термостат, способный поддерживать температуру до 95˚C.
С помощью аналитической системы исследователи надеются сделать диагностику вирусных гепатитов доступной для любого медучреждения, даже если там нет лаборатории.
Читайте также
Биологическая система для измерения и снижения уровня п-Крезола
В 2019 году обладателем гран-при бакалавриата iGEM стала команда тайваньского Национального университета Ченг-Кунг. Участники создали биологические системы для измерения и снижения уровня п-Крезола в крови, которые могут улучшить качество жизни людей с хронической болезнью почек (ХБП).
ХБП — это повреждение почек или нарушение их функции в течение трех месяцев и более. В организме накапливаются уремические токсины, в том числе п-Крезол (п-Крезилсульфат), вырабатываемый в кишечнике. Это вещество не только токсично для организма, но и ухудшает течение ХБП, приводит к сердечно-сосудистым осложнениям.
Команда разработала искусственную кишечную палочку, которая превращает тирозин (предшественник п-Крезола) в p-Кумаровую кислоту — полезное вещество, обладающее антиоксидантными свойствами.
Так исследователи решили проблему накопления уремического токсина в крови еще на стадии его образования.
Кроме этого, биологи из Тайваня придумали аналитическую систему CreSense, которая определяет уровень крезола в крови с помощью живых бактерий. В этой компактной системе поместилась целая лаборатория: реакционная камера, считыватель показателей и центрифуга, которая разделяет кровь на фракции всего за 15 минут. Кровь помещают в микрожидкостный чип. Всё, что нужно сделать пользователю, — это нажать одну кнопку и дождаться результатов, которые выводятся на монитор.

Костюм Человека-паука из искусственного шелка
В 2019 году победителем iGEM среди школьников стала команда из Шэньчжэня. В облачной лаборатории юные экспериментаторы синтезировали паучий шелк и создали из него свою дизайнерскую версию костюма супергероя Питера Паркера.

Натуральный шелк делают из нитей кокона тутового шелкопряда. Однако паучий шелк (белковое волокно, сплетенное пауками) гораздо эластичнее и крепче. Например, паучья нить толщиной 0,1 мм выдерживает вес 90 г, а аналогичная нить шелкопряда — в 5 раз меньше.
Почему же тогда человек не одомашнил паука? Разведение этих хищников — дорогое и трудоемкое занятие. Пауки очень капризные и прожорливые: за сутки одна особь может съесть полсотни мух.
В 2004 году был создан первый синтетический паучий шелк. Его основой стал искусственный фиброин (белок, выделяемый паукообразными).
Школьники из Шэньчжэня пошли аналогичным путем и синтезировали искусственный фиброин в штамме E-coli BL21. Чтобы добиться имитации естественного процесса прядения шелка, они создали 2-компонентное оборудование, которое работало с одинаковой скоростью. Для окраски шелка в синий и красный цвета школьники синтезировали природные пигменты индиго и дезоксивиолацеин.
Перспективы синтетической биологии
За свою недолгую историю существования синтетическая биология доказала, что принципы инженерии позволяют быстро решать проблемы генетики, медицины, фармакологии, промышленности. Мы рассказали лишь о некоторых перспективах развития науки: создание биосистем для диагностики заболеваний, лечения онкологии, наследственных патологий, производства медикаментов, вакцин. Но есть и другие направления:
- выращивание растений с искусственным геномом, которые будут устойчивы к болезням монокультур и смогут самостоятельно фиксировать азот;
- создание биотоплива. Уже сейчас разрабатывают биосистемы, которые могут преобразовывать солнечный свет в чистое биотопливо без ущерба для экологии;
- профилактика распространения заболеваний, переносимых животными. Уже всерьез задумываются о внедрении генов, устойчивых к возбудителям малярии, в популяции малярийных комаров.
